
Wetenschap
Studie onthult structuur van receptor die betrokken is bij diabetes type 2 en meer
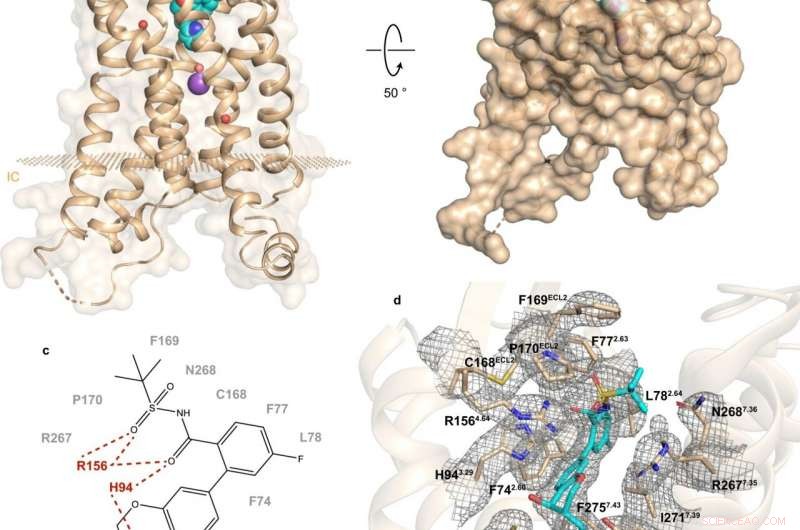
Fig. 1:Structuur en bindingsplaats van hBLT1. Krediet:Michaelian, N., et al. Natuurcommunicatie , https://doi.org/10.1038/s41467-021-23149-1
Onderzoekers van de Universiteit van Zuid-Californië, Merck &Co., Skoltech, MIPT, UCLA, en de Université de Sherbrooke hebben de structuur van de menselijke leukotrieen B4-receptor 1 bepaald. betrokken bij inflammatoire, besmettelijk, allergisch, en tumorverwekkende ziekten. Gepubliceerd in Natuurcommunicatie , de analyse van de structuur onthult hoe de receptor zijn bindingspartners herkent en ermee in wisselwerking staat. Dit opent wegen voor het ontwerpen van betere medicijnen die zich op de receptor zouden richten om type 2-diabetes en andere pathologieën te behandelen.
Receptoren zijn de op eiwitten gebaseerde apparatuur die cellen gebruiken om signalen te ontvangen en te verzenden. Een receptor wordt geactiveerd wanneer het een boodschappermolecuul bindt dat een agonist wordt genoemd, waarna het het signaal doorgeeft, die een bepaalde biologische functie reguleert. antagonisten, daarentegen, sluit de receptor af wanneer gebonden. Agonisten en antagonisten zijn gezamenlijk bekend als liganden.
De menselijke leukotrieen B4-receptor 1, of hBLT1, reguleert ontstekingsgerelateerde processen, zoals de rekrutering van T-cellen, evenals de proliferatie en migratie van gladde spiercellen. Die receptor is in verband gebracht met ziekten, inclusief astma, influenza, artritis, atherosclerose, suikerziekte, en kanker.
Sinds de ontdekking in 1997, er zijn een aantal pogingen geweest om hBLT1-liganden te ontwikkelen voor gebruik als medicijnen, maar ze hadden veel bijwerkingen, lage werkzaamheid, en het lichaam deed er relatief lang over om ze te elimineren. Een waarschijnlijke verklaring hiervoor is dat de gebruikte hBLT1-liganden niet specifiek zijn voor die receptor en betrokken zijn bij andere ongewenste interacties. Door meer te leren over de structuur van de receptor en hoe deze liganden bindt, kunnen farmacologen beter ontwerpen, selectievere medicijnen.
Een recent onderzoek door een Russisch-VS-Canadese samenwerking werpt licht op de samenstelling en werking van hBLT1. Vadim Cherezov, hoogleraar scheikunde aan het USC en hoofd van het MIPT-laboratorium voor structurele biologie van GPCR's, merkte op:"We hebben de kristalstructuur met 2,9-angstrom-resolutie van de hBLT1-receptor in complex met een selectieve antagonist bepaald, MK-D-046, ontwikkeld door Merck &Co. Deze structuur zou moeten helpen om rationeel betere therapieën te ontwerpen voor de behandeling van diabetes type 2 en andere ontstekingsaandoeningen."
Structuurbepaling werd aangevuld met site-directed mutagenese en docking-onderzoeken - een experimentele en een computationele methode, respectievelijk. Volgens Skoltech-assistent-professor Petr Popov, "Dit maakte het mogelijk om de belangrijkste determinanten van intermoleculaire interacties tussen de receptor en de liganden te onthullen."
De analyse van de hBLT1-structuur onthult hoe de receptor liganden herkent en bindt, suggereert een vermoedelijk ligandtoegangskanaal begraven in het membraan van de receptor. Specifieker, de bevindingen wijzen op de mogelijke manieren waarop de receptor zijn endogene agonisten zou kunnen binden. Dat is, verbindingen die van nature door het lichaam worden aangemaakt om aan die receptor te binden en deze te activeren.
Door ons begrip van de structuur en werking van hBLT1 te verbeteren, de studie opent mogelijkheden voor op structuur gebaseerd medicijnontwerp.
 Materiaalwetenschappers creëren stoffen alternatief voor batterijen voor draagbare apparaten
Materiaalwetenschappers creëren stoffen alternatief voor batterijen voor draagbare apparaten Hoe titratieberekeningen uit te voeren
Hoe titratieberekeningen uit te voeren Glasachtig hout isoleert warmte, is moeilijk, blokkeert UV en heeft een houtnerfpatroon
Glasachtig hout isoleert warmte, is moeilijk, blokkeert UV en heeft een houtnerfpatroon Een organisch materiaal voor de volgende generatie HVAC-technologieën
Een organisch materiaal voor de volgende generatie HVAC-technologieën Zee-egelstekels kunnen botten repareren
Zee-egelstekels kunnen botten repareren
Hoofdlijnen
- Hoe de botten in het menselijk skelet te bestuderen
- Wat gebeurt er in de interfase van de celcyclus?
- Wetenschappers identificeren verborgen genetische variatie die de evolutie helpt stimuleren
- Hoe leeuwenbekken hun kleur behouden:bewegwijzeringstruc onthult evolutionair mechanisme
- Belang van vrije ribosomen
- Ver van harpoenen, walvissen schitteren in de boom van ecotoerisme in IJsland
- Enorme golf van vlinders verlicht weerradar van Denver
- Kunnen milieutoxines de biologische klok verstoren?
- Wat is een gen?
- Onderzoekers ontwikkelen zelfaangedreven microfluïdische plaat die zich wikkelt, flappen en kruipen
- Bepaal de creatie van chiraliteit door organische katalysatoren
- Universiteit van Minnesota meldt doorbraak in 3D-printen voor herstel van het ruggenmerg

- Natuurlijke antibiofilm en antimicrobiële peptiden van micro-organismen

- Hoe zuren een naam te geven

 Bosbranden woeden bij Turkse resorts, drie doden
Bosbranden woeden bij Turkse resorts, drie doden Chatbot gelanceerd in strijd tegen desinformatie over COVID-19
Chatbot gelanceerd in strijd tegen desinformatie over COVID-19 Gloednieuwe fysica van supergeleidende metalen weerlegd door natuurkundigen van Lancaster
Gloednieuwe fysica van supergeleidende metalen weerlegd door natuurkundigen van Lancaster Chaotische magnetische veldlijnen kunnen het coronale verwarmingsprobleem oplossen
Chaotische magnetische veldlijnen kunnen het coronale verwarmingsprobleem oplossen Krassen op het oppervlak:metalen implantaten van glas
Krassen op het oppervlak:metalen implantaten van glas Caribische kust van Mexico getroffen door zwaar zeewier, meer verwacht
Caribische kust van Mexico getroffen door zwaar zeewier, meer verwacht Een grotere kraamkamer voor de zonnestelsels vormde eerst vaste stoffen
Een grotere kraamkamer voor de zonnestelsels vormde eerst vaste stoffen Magmaopslag en uitbarstingsgedrag bij vulkaan Bali
Magmaopslag en uitbarstingsgedrag bij vulkaan Bali
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

