
Wetenschap
Waarom is stikstof slecht oplosbaar in water?
1. Niet-polaire aard: Stikstof is een niet-polair molecuul, wat betekent dat het geen significante elektrische lading heeft. Water daarentegen is een polair molecuul met een gedeeltelijk positieve lading op de waterstofatomen en een gedeeltelijk negatieve lading op het zuurstofatoom. Niet-polaire moleculen hebben over het algemeen geen sterke interactie met polaire moleculen, wat leidt tot een beperkte oplosbaarheid.
2. Sterke intermoleculaire krachten: Stikstofmoleculen hebben sterke intermoleculaire krachten die bekend staan als van der Waals-krachten. Deze krachten komen voort uit de aantrekkingskracht tussen de licht positieve en negatieve gebieden van aangrenzende moleculen. De kracht van deze krachten tussen stikstofmoleculen houdt ze stevig op elkaar gepakt, waardoor het vermogen van watermoleculen om stikstofgas binnen te dringen en op te lossen wordt verminderd.
3. Lage polariseerbaarheid: Polariseerbaarheid verwijst naar het vermogen van een molecuul om zijn elektronenwolk te vervormen als reactie op een elektrisch veld. Stikstofmoleculen hebben een lage polariseerbaarheid, wat betekent dat ze niet gemakkelijk worden vervormd of vervormd door het elektrische veld van watermoleculen. Dit verzwakt de interacties tussen stikstof en water verder, wat resulteert in een verminderde oplosbaarheid.
4. Hoog kookpunt: Stikstof heeft een relatief hoog kookpunt (-195,8°C) vergeleken met andere gassen zoals zuurstof en kooldioxide. Het kookpunt van een stof is een indicator voor de sterkte van zijn intermoleculaire krachten. Het hogere kookpunt van stikstof duidt op sterkere intermoleculaire krachten, waardoor het minder waarschijnlijk is dat het in water oplost.
5. Hydratie-energie: Hydratatie-energie verwijst naar de energie die vrijkomt wanneer ionen of polaire moleculen interageren met watermoleculen en omgeven worden door een hydratatieschil. Stikstof, omdat het een niet-polair molecuul is, ondergaat geen significante hydratatie. Het ontbreken van gunstige hydratatie-interacties draagt verder bij aan de lage oplosbaarheid ervan in water.
In tegenstelling tot stikstof zijn gassen zoals zuurstof en kooldioxide beter oplosbaar in water vanwege hun hogere polariteit, zwakkere intermoleculaire krachten, lagere kookpunten en gunstiger hydratatie-interacties.
 Franse tests met VW-auto's 'laten fraude door vervuiling zien'
Franse tests met VW-auto's 'laten fraude door vervuiling zien'  De synthese van de bacteriële celwand in realtime volgen
De synthese van de bacteriële celwand in realtime volgen Eigenschappen van spinnenzijde geanalyseerd voor gebruik als biogebaseerde vezels in de medische sector
Eigenschappen van spinnenzijde geanalyseerd voor gebruik als biogebaseerde vezels in de medische sector Wat is het aantal protonen in argongas?
Wat is het aantal protonen in argongas?  NOx-gassen in de dampen van dieselauto's:waarom zijn ze zo gevaarlijk?
NOx-gassen in de dampen van dieselauto's:waarom zijn ze zo gevaarlijk?
 Wereldwijd kankerrisico door verbranding van organisch materiaal komt van niet-gereguleerde chemicaliën
Wereldwijd kankerrisico door verbranding van organisch materiaal komt van niet-gereguleerde chemicaliën Soorten knaagdieren in California
Soorten knaagdieren in California Pedaalkracht zwaait Moskovieten ondanks gevaren
Pedaalkracht zwaait Moskovieten ondanks gevaren Onderzoekers ontwikkelen een nieuwe manier om droogte te voorspellen
Onderzoekers ontwikkelen een nieuwe manier om droogte te voorspellen Enorme gasfabriek hervat haar activiteiten na zware PNG-aardbeving
Enorme gasfabriek hervat haar activiteiten na zware PNG-aardbeving
Hoofdlijnen
- Waarom genoombewerking een gerichte manier biedt om betere gewassen te veredelen
- Hoe een onbekende bacterie te identificeren in de microbiologie
- Klimaatverandering verlengt, intensiveert de bloei van steeneik en andere Quercus-soorten:studie
- Macht overdragen aan staten zal de bescherming van bedreigde diersoorten niet verbeteren
- Neem een dosis Dickinson:poëzie als therapie
- Toch niet zo verschillend:menselijke cellen, winterharde microben delen een gemeenschappelijke voorouder
- Hoe orgaanfuncties in de loop van de evolutie werden gevormd
- Oud menselijk DNA geeft aan waarom multiple sclerose tegenwoordig zoveel Noord-Europeanen treft
- Zijn mensen zonder verstandskiezen hoger ontwikkeld?
- Een nieuwe tool om eiwitten aan en uit te zetten

- Onderzoekers gebruiken röntgenstralen om de tekortkomingen van het snel opladen van batterijen te begrijpen

- Artificial Chemist 2.0:Quantum dot R&D in minder dan een uur
- Nieuw kwantummateriaal kan waarschuwen voor neurologische aandoeningen

- Elektriciteit opwekken in estuaria met licht en osmose
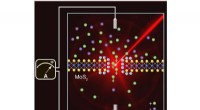
 Wat zou er gebeuren als de aarde zou stoppen met draaien?
Wat zou er gebeuren als de aarde zou stoppen met draaien?  Rotsen en edelstenen polijsten zonder een steen Tumbler
Rotsen en edelstenen polijsten zonder een steen Tumbler De verlaging van het ijsoppervlak van de Skelton-gletsjer is te wijten aan de terugtrekking van het ijs in de Rosszee
De verlaging van het ijsoppervlak van de Skelton-gletsjer is te wijten aan de terugtrekking van het ijs in de Rosszee Twitter sluit Chinese accounts gericht op protesten in Hong Kong
Twitter sluit Chinese accounts gericht op protesten in Hong Kong Amazoneboeren ontdekten het geheim van het domesticeren van wilde rijst 4, 000 jaar geleden
Amazoneboeren ontdekten het geheim van het domesticeren van wilde rijst 4, 000 jaar geleden Jack Horner
Jack Horner  Heeft het zijn smaak behouden? Kauwgom uit het stenen tijdperk levert menselijk DNA op
Heeft het zijn smaak behouden? Kauwgom uit het stenen tijdperk levert menselijk DNA op Welke reptielen leggen geen eieren?
Welke reptielen leggen geen eieren?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

