
Wetenschap
je hebt 500 ml van een 1,5 m hcl-oplossing (zuur). als er 250 koh aanwezig is (basis). wat zal de molariteit (basis) zijn?
HCl + KOH → KCl + H₂O
Uit de uitgebalanceerde chemische vergelijking kunnen we zien dat 1 mol HCl reageert met 1 mol KOH. Daarom is het aantal mol KOH dat in de oplossing aanwezig is gelijk aan het aantal mol HCl dat heeft gereageerd.
Om het aantal mol HCl te berekenen dat heeft gereageerd, kunnen we de formule gebruiken:
Aantal mol HCl gereageerd =molariteit HCl x volume HCl
Als we de gegeven waarden in de formule vervangen, krijgen we:
Mol gereageerd HCl =1,5 M x 0,5 L =0,75 mol
Omdat 1 mol HCl reageert met 1 mol KOH, bedraagt het aantal mol KOH dat in de oplossing aanwezig is eveneens 0,75 mol.
Om de molariteit van de KOH in de oplossing te berekenen, kunnen we de formule gebruiken:
Molariteit van KOH =Mol KOH / Volume oplossing
Als we de bekende waarden in de formule vervangen, krijgen we:
Molariteit van KOH =0,75 mol / 0,5 L =1,5 M
Daarom is de molariteit van de KOH (base) in de oplossing 1,5 M.
 Zullen tornado's en waterhozen gedijen als de aarde opwarmt?
Zullen tornado's en waterhozen gedijen als de aarde opwarmt?  Twee decennia van orkanen veranderen kustecosystemen - verhogen algenbloei, vis doodt, dode zones
Twee decennia van orkanen veranderen kustecosystemen - verhogen algenbloei, vis doodt, dode zones Veranderende eetgewoonten om klimaatverandering aan te pakken onbereikbaar voor minderheidsgroepen
Veranderende eetgewoonten om klimaatverandering aan te pakken onbereikbaar voor minderheidsgroepen Waarom orkanen sommige plaatsen keer op keer verwoesten:een meteoroloog legt uit
Waarom orkanen sommige plaatsen keer op keer verwoesten:een meteoroloog legt uit Klimaatpioniers:hoe kleine boeren de weg kunnen wijzen naar duurzame landbouw
Klimaatpioniers:hoe kleine boeren de weg kunnen wijzen naar duurzame landbouw
Hoofdlijnen
- Secretine-eiwit met een kroon
- Hoe weet je of je man of vrouw bent?
- Productietijden kunnen het illegaal witwassen van wilde dieren tegengaan
- Onder vuur:Onderzoekers werpen licht op hoe de ziekte van Lyme het lichaam infecteert
- De nadelen van biotechnologie
- Wat is de naam van uit dierlijke polysachariden samengestelde glucose-eenheden?
- Hoe beïnvloedt het sociale gedrag van tarweplanten de graanproductie?
- Hoe vitamines, steroïden en mogelijke antivirale middelen SARS-CoV-2 kunnen beïnvloeden
- Waarom natuurlijke killercellen reageren op COVID-19
- Nieuw proces kan de levensduur van metalen verlengen

- Vlam aan! Hoe AI een complexe materiaaltechniek kan temmen en de productie kan transformeren

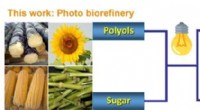
- Nieuwe fotokatalytische methode zet biopolyolen en suikers om in methanol en syngas
- Spingif sleutel tot pijnverlichting zonder bijwerkingen

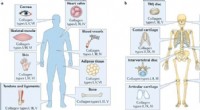
- Onderzoekers kwantificeren, karakteriseren en identificeren functies van collageen, zijn subtypes
 Energie opslaan met eierschalen
Energie opslaan met eierschalen De waterstofproductie versnellen door de magische topologische oppervlaktetoestanden
De waterstofproductie versnellen door de magische topologische oppervlaktetoestanden Wat botproteomics over de doden zouden kunnen onthullen
Wat botproteomics over de doden zouden kunnen onthullen  Hoe een ballonwagen te maken die sneller gaat
Hoe een ballonwagen te maken die sneller gaat Hoe onderzoekers de voorouder van al het leven op aarde reconstrueerden
Hoe onderzoekers de voorouder van al het leven op aarde reconstrueerden  Door koppelingen aangedreven moleculaire tandwielen in kristallen kunnen materiaalinnovatie stimuleren
Door koppelingen aangedreven moleculaire tandwielen in kristallen kunnen materiaalinnovatie stimuleren  Honda vertraagt Accord, Civic-productie terwijl kopers overschakelen op SUV's
Honda vertraagt Accord, Civic-productie terwijl kopers overschakelen op SUV's De effecten van temperatuur op enzymactiviteit en biologie
De effecten van temperatuur op enzymactiviteit en biologie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

