
Wetenschap
Wat is de verhouding tussen zuivere en hybride orbitalen in butaan?
Buteen bevat zowel zuivere (sp3) als gehybridiseerde (sp2) orbitalen.
Er zijn vier koolstofatomen en tien waterstofatomen in butaan. Elk koolstofatoom ondergaat sp3-hybridisatie, wat resulteert in de vorming van vier gelijkwaardige sp3-hybride orbitalen. Deze sp3-orbitalen overlappen met de 1s-orbitalen van waterstofatomen en vormen tien C-H-sigmabindingen.
Er is echter geen hybridisatie in de koolstof-koolstofbinding. De koolstof-koolstofbinding in butaan wordt gevormd door de overlap van twee sp3-orbitalen, één van elk koolstofatoom. Dit type binding staat bekend als een sigma-binding en is het sterkste type covalente binding.
Daarom bevat butaan geen zuivere of gehybridiseerde orbitalen.
 Onderzoek wijst op een toegenomen bedreiging voor kustlijnen als gevolg van gelijktijdige hittegolven en stijging van de zeespiegel
Onderzoek wijst op een toegenomen bedreiging voor kustlijnen als gevolg van gelijktijdige hittegolven en stijging van de zeespiegel  Microbiële biomassaverandering verschuift de rol van ijzeroxiden in organische C-mineralisatie in anoxische padiegrond
Microbiële biomassaverandering verschuift de rol van ijzeroxiden in organische C-mineralisatie in anoxische padiegrond Grote aardbeving treft Fiji, maar geen tsunami-waarschuwing afgegeven
Grote aardbeving treft Fiji, maar geen tsunami-waarschuwing afgegeven EU stemt in met hervorming van grootste koolstofmarkt ter wereld
EU stemt in met hervorming van grootste koolstofmarkt ter wereld Nieuwe regel kan de bescherming tegen vervuiling van populaire meren verwijderen
Nieuwe regel kan de bescherming tegen vervuiling van populaire meren verwijderen
Hoofdlijnen
- Welke mRNA-codons zullen het translatieproces starten?
- Kan de wetenschap bendemoorden voorspellen?
- EU doorbreekt patstelling om licentie op controversiële onkruidverdelger te verlengen (update 3)
- Nieuw onderzoek naar de geheimen van het bos:de Finse boompopulatie bestaat uit families en buurten
- Hoe een klein en vreemd zeedier gedurende zijn hele leven onbeperkt sperma produceert
- Great Salt Lake op weg naar hyperzoutgehalte, spiegelend Iraans meer, blijkt uit nieuw onderzoek
- Studie onderzoekt welke micro-organismen op Mars nodig zouden hebben om te overleven
- WAT IS DE NAAM VAN DE MAAGCEL DIE ZOUTZUUR AFSCHEIDT?
- Hoe stamcellen huid maken
- Materiaalwetenschappers bouwen een synthetisch systeem met compartimenten zoals echte cellen
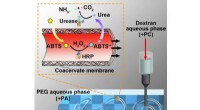
- Nieuw upcycling-systeem voor commerciële polyesters

- Onderzoekers ontdekken methode om kruidensupplement curcumine aan kankercellen te leveren door de onoplosbaarheid ervan op te lossen
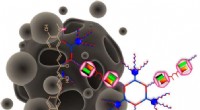
- Polymeeronderzoekers ontdekken pad naar duurzame en biologisch afbreekbare polyesters

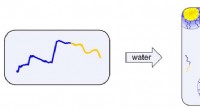
- een nieuwe, snellere manier om diblock-polymeermaterialen te verwerken
 Hoe zijn waterstofnatrium en rubidium vergelijkbaar?
Hoe zijn waterstofnatrium en rubidium vergelijkbaar?  Hoe ontwikkelden dinosaurussen snavels en werden vogels? Wetenschappers denken dat ze het antwoord hebben
Hoe ontwikkelden dinosaurussen snavels en werden vogels? Wetenschappers denken dat ze het antwoord hebben Ambtenaren proberen grote overlaat op de rivier de Mississippi te openen
Ambtenaren proberen grote overlaat op de rivier de Mississippi te openen Hoe verschillen de smelt- en kookpunten van water van die van een suikeroplossing?
Hoe verschillen de smelt- en kookpunten van water van die van een suikeroplossing?  Hebben kunststoffen een lager smeltpunt dan metalen?
Hebben kunststoffen een lager smeltpunt dan metalen?  Nanobuiscomposieten verhogen de efficiëntie van de volgende generatie zonnecellen
Nanobuiscomposieten verhogen de efficiëntie van de volgende generatie zonnecellen Kleur van licht veranderen met behulp van een tijdruimtelijke grens
Kleur van licht veranderen met behulp van een tijdruimtelijke grens Nieuwe optische waterstofsensoren elimineren het risico op vonken
Nieuwe optische waterstofsensoren elimineren het risico op vonken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

