
Wetenschap
Hoe verschillen de smelt- en kookpunten van water van die van een suikeroplossing?
Zuiver water heeft een smeltpunt van 0 graden Celsius (32 graden Fahrenheit). Dit betekent dat er bij of onder deze temperatuur water in vaste vorm bestaat, ook wel ijs genoemd. Aan de andere kant heeft een suikeroplossing een lager smeltpunt vergeleken met zuiver water. De aanwezigheid van opgeloste suikerdeeltjes verstoort het kristalrooster van water, waardoor het bij een lagere temperatuur smelt. De mate waarmee het smeltpunt van water wordt verlaagd, hangt af van de concentratie van de suikeroplossing. Hoe geconcentreerder de oplossing, hoe lager het smeltpunt.
Kookpunt
Het kookpunt van zuiver water is 100 graden Celsius (212 graden Fahrenheit) op zeeniveau. Dit is de temperatuur waarbij water verandert van een vloeistof in een damp of gas. Het toevoegen van suiker aan water verhoogt het kookpunt. De opgeloste suikerdeeltjes verstoren de vorming van waterdampbellen, waardoor het voor de vloeistof moeilijker wordt om in een gas te veranderen. Hoe hoger de suikerconcentratie, hoe hoger het kookpunt van de oplossing.
Samenvattend is het smeltpunt van een suikeroplossing lager dan dat van zuiver water, terwijl het kookpunt hoger is. Deze veranderingen zijn directe gevolgen van de aanwezigheid van opgeloste suikerdeeltjes, die de intermoleculaire interacties in water verstoren en de fysische eigenschappen ervan veranderen. Het begrijpen van de smelt- en kookpunten van suikeroplossingen is van cruciaal belang op verschillende gebieden, waaronder de voedingswetenschap, chemie en techniek, waar het beheersen van deze eigenschappen essentieel is voor specifieke toepassingen.
 Onderzoekers realiseren de ideale elektronische structuur van kagome-metaal
Onderzoekers realiseren de ideale elektronische structuur van kagome-metaal Kijk mam, geen handen:onderzoekers gebruiken vacuüm voor handsfree patroonvorming van vloeibaar metaal
Kijk mam, geen handen:onderzoekers gebruiken vacuüm voor handsfree patroonvorming van vloeibaar metaal Regeling in de tijd van chemische reacties met alleen hoorbaar geluid
Regeling in de tijd van chemische reacties met alleen hoorbaar geluid Waarom is het voor ons allemaal belangrijk om enig begrip van scheikunde te hebben?
Waarom is het voor ons allemaal belangrijk om enig begrip van scheikunde te hebben?  Atomen naar grammen converteren met een rekenmachine
Atomen naar grammen converteren met een rekenmachine
 Afbeelding:Copernicus Sentinel-2A-satelliet legt de wetlands van Botswana vast
Afbeelding:Copernicus Sentinel-2A-satelliet legt de wetlands van Botswana vast Krachtige tyfoon raast over Filipijnen kerst bederven (update)
Krachtige tyfoon raast over Filipijnen kerst bederven (update) Waterdesinfectie met ozon
Waterdesinfectie met ozon Welke vissen helpen een vijver op te ruimen?
Welke vissen helpen een vijver op te ruimen?  Biobased plastics kunnen afval verminderen, maar alleen als we investeren in het maken en wegwerken ervan
Biobased plastics kunnen afval verminderen, maar alleen als we investeren in het maken en wegwerken ervan
Hoofdlijnen
- Waarom zijn sommige wezens banger voor verandering dan andere?
- Laten video's de ivoorsnavelspecht zien, of is deze uitgestorven?
- Een ongewoon wezen ontwaakt uit de winterslaap. Dit is waarom wetenschappers enthousiast zijn.
- Aard-lucht warmtewisselaar beste manier om landbouwhuisdieren in stallen te beschermen tegen de gevolgen van klimaatverandering
- Great Basin zaadstudie-experiment richt zich op herstel van weidegronden
- Wat maakt avocado’s eigenlijk slecht voor het milieu?
- Wat zijn de vier belangrijkste bloedgroepen?
- Zeg vaarwel tegen knoflookadem met geurvrije zwarte knoflook
- Waarom het twintig jaar duurde om het menselijk genoom ‘af te maken’ – en waarom er nog meer te doen is
- Waarom tandpasta en cement na verloop van tijd uitharden?

- Elektrofotokatalytische diaminatie van vicinale C-H-bindingen
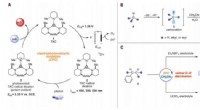
- Zelfherstellende vloeistof brengt nieuw leven in batterijalternatief
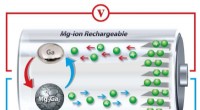
- Nieuwe manier om littekens op de huid te verminderen, is gebaseerd op een lijmachtige substantie die wordt afgescheiden door mosselen

- Door het smelten van een elektronenbundel krijgt bros metaal vorm

 De atmosfeer van de zon bestuderen met de totale zonsverduistering van 2017
De atmosfeer van de zon bestuderen met de totale zonsverduistering van 2017 Wanneer consumenten zoeken naar authenticiteit:in het oog van de toeschouwer?
Wanneer consumenten zoeken naar authenticiteit:in het oog van de toeschouwer?  De spin in grafeen kan worden uitgeschakeld
De spin in grafeen kan worden uitgeschakeld Studie:Kinderen uit rijkere families voelen meer controle over hun leven
Studie:Kinderen uit rijkere families voelen meer controle over hun leven Vriesverbranding is een serieus probleem:het voorkomen van herkristallisatie van ijs kan dit verlichten
Vriesverbranding is een serieus probleem:het voorkomen van herkristallisatie van ijs kan dit verlichten Kleine organismen werpen een groot licht op voedingsstoffen in de oceaan
Kleine organismen werpen een groot licht op voedingsstoffen in de oceaan Geschreven op water:reconstructie van de oude geschiedenis van een oceaanstroom
Geschreven op water:reconstructie van de oude geschiedenis van een oceaanstroom Uit onderzoek blijkt dat de kliffen aan de kust van Californië afbrokkelen zonder waarneembaar patroon
Uit onderzoek blijkt dat de kliffen aan de kust van Californië afbrokkelen zonder waarneembaar patroon
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

