
Wetenschap
Er zit 2 gram H2-gas in een container met een vast volume van 273 C. 16 Hij wordt toegevoegd aan de en de temperatuur wordt verhoogd 819 Dus welke verhouding einddruk begindruk?
De ideale gaswet stelt dat:
PV =nRT
waarbij P de druk is, V het volume, n het aantal mol gas, R de ideale gasconstante en T de temperatuur.
Als het volume vast is, kunnen we schrijven:
P =nRT/V
Laten we de begindruk berekenen met behulp van H2-gas:
n(H2) =2 g / 2 g/mol =1 mol
P1 =n(H2)RT1/V
P1 =(1 mol)(0,08206 L*atm/mol*K)(273 K)/V
P1 =22,4 atm
Laten we nu de einddruk berekenen met behulp van H2- en He-gassen:
n(totaal) =n(H2) + n(He) =1 mol + 2 mol =3 mol
P2 =n(totaal)RT2/V
P2 =(3 mol)(0,08206 L*atm/mol*K)(1092 K)/V
P2 =86 atm
Daarom is de verhouding tussen einddruk en begindruk:
P2/P1 =86 atm/22,4 atm =3,8
De druk nam dus 3,8 keer toe.
 Hoe een spin te identificeren door Web Pattern
Hoe een spin te identificeren door Web Pattern Onderzoekers ontdekken dat pompen jong grondwater naar nieuwe diepten trekt, mogelijk met verontreinigingen op sleeptouw
Onderzoekers ontdekken dat pompen jong grondwater naar nieuwe diepten trekt, mogelijk met verontreinigingen op sleeptouw Langetermijnstudie toont aan dat vruchtwisseling de uitstoot van broeikasgassen vermindert
Langetermijnstudie toont aan dat vruchtwisseling de uitstoot van broeikasgassen vermindert Zijn latex en plastic hetzelfde?
Zijn latex en plastic hetzelfde?  Wat een mislukt Johannesburg-project ons vertelt over megasteden in Afrika
Wat een mislukt Johannesburg-project ons vertelt over megasteden in Afrika
Hoofdlijnen
- Hoe soorten versteend hout te identificeren
- Onderzoekers identificeren hoe bacterie overleeft in zuurstofarme omgevingen
- Waarom gebruikte Hooky de term cellen?
- Telt de menselijke mond als orgaan?
- Celcontractie drijft de initiële vorming van menselijke embryo's aan, zo blijkt uit onderzoek
- Kun jij de vier belangrijkste biomen van BC noemen?
- Wat is de fase in de mitose waarin het kernmembraan verdwijnt?
- Sportpartnerschappen met non-profitorganisaties laten matige resultaten zien, zo blijkt uit onderzoek
- Studie:Baby Kinda bavianen worden sneller onafhankelijk als moeders sociaal en dominant zijn
- Wat maakt een gigantische kwal dodelijk?

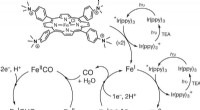
- Kooldioxide omzetten in methaan met behulp van ijzer en zonlicht
- Van recycling naar upcycling:slimmer omgaan met plastic
- Onderzoekers gaan ruw om met nanomaterialen om problematische plakkerigheid veroorzaakt door gladde oppervlakken te elimineren

- Wetenschappers maken vanadium tot een bruikbare katalysator voor hydrogenering

 China versoepelt geboortegrenzen verder om de vergrijzing van de samenleving het hoofd te bieden
China versoepelt geboortegrenzen verder om de vergrijzing van de samenleving het hoofd te bieden Hoe twee vloeistoffen zich aan het oppervlak vermengen:een atomair beeld
Hoe twee vloeistoffen zich aan het oppervlak vermengen:een atomair beeld  Hoe bosbranden grotere gevolgen kunnen hebben voor wolkenvorming dan eerder werd gedacht
Hoe bosbranden grotere gevolgen kunnen hebben voor wolkenvorming dan eerder werd gedacht  NASA-NOAA-satelliet volgt overblijfselen van tropische storm Blakes die zich verspreiden
NASA-NOAA-satelliet volgt overblijfselen van tropische storm Blakes die zich verspreiden Tool voor kunstmatige intelligentie ontwikkeld om de structuur van het universum te voorspellen
Tool voor kunstmatige intelligentie ontwikkeld om de structuur van het universum te voorspellen Extreem agressieve internetcensuur verspreidt zich in de democratieën van de wereld
Extreem agressieve internetcensuur verspreidt zich in de democratieën van de wereld Word je gek? Turkije wil dat pistachenoten een nieuwe ecostad verwarmen
Word je gek? Turkije wil dat pistachenoten een nieuwe ecostad verwarmen  97% van de inheemse bevolking meldt wekelijks negatieve sociale media-inhoud te zien
97% van de inheemse bevolking meldt wekelijks negatieve sociale media-inhoud te zien
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

