
Wetenschap
Hoe wordt een ionische binding gevormd?
De vorming van een ionische binding kan worden verklaard door de volgende stappen:
1. Elektronenoverdracht :Atomen met verschillende elektronegativiteiten hebben verschillende capaciteiten om elektronen aan te trekken. Wanneer atomen met significant verschillende elektronegativiteiten dicht bij elkaar komen, trekt het atoom met hogere elektronegativiteit de elektronen aan van het atoom met lagere elektronegativiteit. Dit resulteert in de overdracht van een of meer elektronen van het ene atoom naar het andere.
2. Vorming van ionen :Het atoom dat elektronen verliest, wordt positief geladen en vormt een kation, terwijl het atoom dat elektronen wint negatief geladen wordt en een anion vormt.
3. Elektrostatische aantrekkingskracht :Het positief geladen kation en het negatief geladen anion worden vervolgens bij elkaar gehouden door de elektrostatische aantrekkingskracht tussen hen. Deze elektrostatische kracht vormt de ionische binding.
De sterkte van de ionische binding hangt af van verschillende factoren, waaronder:
- Lading van de ionen :Hoe groter de lading van de ionen, hoe sterker de ionische binding. Dit komt omdat de elektrostatische aantrekkingskracht tussen de ionen toeneemt naarmate de lading toeneemt.
- Grootte van de ionen :Hoe kleiner de ionen, hoe sterker de ionische binding. Dit komt omdat kleinere ionen een hogere ladingsdichtheid hebben, wat resulteert in een sterkere elektrostatische aantrekkingskracht.
- Afstand tussen ionen :Hoe korter de afstand tussen de ionen, hoe sterker de ionische binding. Dit komt omdat de elektrostatische aantrekkingskracht tussen de ionen afneemt naarmate de afstand ertussen groter wordt.
Ionische bindingen worden vaak aangetroffen in verbindingen gevormd tussen metalen en niet-metalen, zoals natriumchloride (NaCl), kaliumjodide (KI) en magnesiumoxide (MgO). Deze verbindingen bestaan uit positief geladen metaalionen en negatief geladen niet-metaalionen die bij elkaar worden gehouden door sterke ionische bindingen.
 Nylon 6-6 groener maken, en zonder zink
Nylon 6-6 groener maken, en zonder zink Een enzym dat in wasmiddel wordt gebruikt, kan plastic voor eenmalig gebruik binnen 24 uur recyclen
Een enzym dat in wasmiddel wordt gebruikt, kan plastic voor eenmalig gebruik binnen 24 uur recyclen  Nieuwe methode om uranium in zeewater te verrijken
Nieuwe methode om uranium in zeewater te verrijken Wetenschappers gaan nieuwe chemische neuzen maken om het milieu te ontdoen van industriële verontreinigende stoffen
Wetenschappers gaan nieuwe chemische neuzen maken om het milieu te ontdoen van industriële verontreinigende stoffen Wat zijn de subatomaire artikelen die kunnen veranderen tijdens een kernreactie?
Wat zijn de subatomaire artikelen die kunnen veranderen tijdens een kernreactie?
Hoofdlijnen
- Hoe technologie en robotica Brazilië helpen bij het monitoren van de beheersing van een invasieve koraalsoort
- Heeft een brein in een gerecht morele rechten?
- 'S Werelds oudste bevroren sperma werkt prima
- De gevaarlijkste gebieden voor aanvaringen met schepen met walvishaaien onthuld
- Zijn voedingsmiddelen gemaakt met behulp van biotechnologie veilig om te eten?
- Opwarmende oceanen veranderen Australische populaties rifvissen
- Onderzoek toont aan hoe de wiskunde- en wetenschappelijke identiteit bij studenten de resultaten op de universiteit en carrière beïnvloedt
- Als het gaat om hoe pizza eruit ziet, is kaas belangrijk
- Waarom helpen rijmpjes mensen dingen te onthouden?
- Wortelcement:hoe wortelgroenten en as beton duurzamer kunnen maken

- Chemische datamining stimuleert zoektocht naar nieuwe organische halfgeleiders

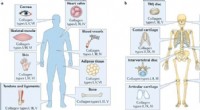
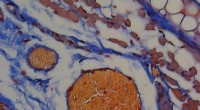
- Onderzoekers kwantificeren, karakteriseren en identificeren functies van collageen, zijn subtypes
- Wetenschappers leren meer over de eerste uren van de levensduur van lithium-ionbatterijen

- Met behulp van licht, rode bloedcellen en een honingbijpeptide om therapeutische eiwitten te leveren
 Bell Prize gaat naar wetenschappers die hebben bewezen dat spookachtige kwantumverstrengeling echt is
Bell Prize gaat naar wetenschappers die hebben bewezen dat spookachtige kwantumverstrengeling echt is Hoe goud te vinden in kwarts
Hoe goud te vinden in kwarts  Kristallen deurknoppen identificeren
Kristallen deurknoppen identificeren Uit onderzoek blijkt dat nikkelaatsupergeleiders intrinsiek magnetisch zijn
Uit onderzoek blijkt dat nikkelaatsupergeleiders intrinsiek magnetisch zijn New kid on the block pikt relais voor ozon op
New kid on the block pikt relais voor ozon op Waarom theepotten altijd druppelen
Waarom theepotten altijd druppelen Versnelde mariene koolstofcycli, veroorzaakt door tektonische ontgassing tijdens het Mioceen Climate Optimum
Versnelde mariene koolstofcycli, veroorzaakt door tektonische ontgassing tijdens het Mioceen Climate Optimum  Wat hebben bacteriën nodig om te leven?
Wat hebben bacteriën nodig om te leven?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

