
Wetenschap
Waarom bestaat N2 als gas, terwijl P een vaste stof is?
Als gevolg van de kleinere atomaire grootte van stikstof heeft het een grotere ionisatie-enthalpie dan fosfor. Stikstof heeft dus een grotere neiging om elektronen vast te houden. Stikstof-stikstofbindingen zijn veel sterker dan fosfor-fosforbindingen. Hierdoor bestaat fosfor als P4-moleculen, terwijl stikstof bestaat als N2-moleculen. Door de aanwezigheid van meerdere bindingen tussen stikstofatomen is het N2-molecuul vrij inert. Als gevolg hiervan bestaat N2 als gas bij kamertemperatuur. Aan de andere kant vormt fosfor bindingen met zichzelf, wat resulteert in de vorming van P4, een polymeermolecuul dat daarom een hoog smeltpunt heeft en als een vaste stof bij kamertemperatuur bestaat.
 Onderzoek toont aan dat toegenomen vocht de afname van Afrikaanse branden faciliteerde
Onderzoek toont aan dat toegenomen vocht de afname van Afrikaanse branden faciliteerde Hoe ziet de aarde er over 500 jaar uit?
Hoe ziet de aarde er over 500 jaar uit?  Typen bedreigde regenwoudplanten
Typen bedreigde regenwoudplanten Amerikaanse publieke opinie over klimaat en energie
Amerikaanse publieke opinie over klimaat en energie Bomen en struiken in de buurt van snelwegen kunnen de luchtvervuiling aanzienlijk verminderen, blijkt uit onderzoek
Bomen en struiken in de buurt van snelwegen kunnen de luchtvervuiling aanzienlijk verminderen, blijkt uit onderzoek
Hoofdlijnen
- Wat is een symbiotische relatie?
- Genetische analyses onthullen nieuwe virussen aan de horizon
- Alles in de familie:gerichte genomische vergelijkingen
- Een plaag van onze eigen makelij:het onthullen van de ware oorsprong van de niet zo Duitse kakkerlak
- Evolutionair celbiologisch onderzoek laat zien hoe de energieproductie kan worden geoptimaliseerd om snelle groei zonder ademhaling te garanderen
- Uit onderzoek blijkt hoe gemakkelijk het is om iemands identiteit vast te stellen met mobiele telefoongegevens
- Groter en levensechter:wat is de toekomst van biogeprinte organen?
- Een geval van chimpansees of een grote uitbraak? Syndromale surveillance kan van cruciaal belang zijn
- Welke microben leven in je buik? Een microbioloog probeert thuis testkits om te zien wat ze onthullen over het microbioom
- Hoe kathodische corrosie van metaalelektroden bij elektro-organische synthese te voorkomen?

- Hightech oppervlakken kunnen de weerstand en CO2-uitstoot van schepen aanzienlijk verminderen

- Moleculaire steigers helpen constructie op nanoschaal
- Onderzoekers onthullen verborgen genetische regels voor hoe het leven op aarde begon

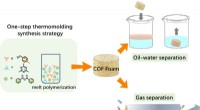
- Gebruik van smeltpolymerisatie om robuust covalent organisch raamwerkschuim te fabriceren
 Onderzoekers:Dit is wat er met werknemers gebeurt als kolencentrales in Australië sluiten. Het is niet goed
Onderzoekers:Dit is wat er met werknemers gebeurt als kolencentrales in Australië sluiten. Het is niet goed  Wetenschappers ontwikkelen metaalvrije fotokatalysator om pathogeenrijk water binnen enkele minuten te zuiveren
Wetenschappers ontwikkelen metaalvrije fotokatalysator om pathogeenrijk water binnen enkele minuten te zuiveren Wat een nooit eerder gezien radioactief verval ons kan vertellen over neutrino's
Wat een nooit eerder gezien radioactief verval ons kan vertellen over neutrino's Interactieve besturing om industriële robots te begeleiden
Interactieve besturing om industriële robots te begeleiden Heeft een element dat elektronen verliest bij binding met andere atomen een negatief oxidatiegetal?
Heeft een element dat elektronen verliest bij binding met andere atomen een negatief oxidatiegetal?  Nieuwe analyse onthult wereldwijde verspreiding van giftige vervuiling en klimaatverandering
Nieuwe analyse onthult wereldwijde verspreiding van giftige vervuiling en klimaatverandering Waarom een stroom plasma chemische reacties efficiënter maakt?
Waarom een stroom plasma chemische reacties efficiënter maakt? Duizenden liters goed:LSU-chemici helpen Louisiana bij het bereiden van grote hoeveelheden handontsmettingsmiddel
Duizenden liters goed:LSU-chemici helpen Louisiana bij het bereiden van grote hoeveelheden handontsmettingsmiddel
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

