
Wetenschap
Ontsnappen aan kinetische vallen:hoe moleculaire interacties het mogelijk maken om de energiebarrière te overwinnen
Bij thermische activering haalt het molecuul energie uit de omgeving in de vorm van warmte. Deze energie kan worden gebruikt om de energiebarrière te overwinnen en aan de kinetische val te ontsnappen. De snelheid van thermische activering wordt bepaald door de temperatuur en de hoogte van de energiebarrière.
Kwantumtunneling is een fenomeen dat moleculen in staat stelt energiebarrières te passeren zonder voldoende energie te verkrijgen om deze te overwinnen. Dit is mogelijk omdat moleculen een golfachtig karakter hebben en daarom door barrières heen kunnen tunnelen die veel hoger zijn dan hun energie. De snelheid van kwantumtunneling wordt bepaald door de breedte van de energiebarrière en de massa van het molecuul.
Mechanische kracht kan ook worden gebruikt om kinetische vallen te overwinnen. Dit kan worden gedaan door een kracht op het molecuul uit te oefenen die groter is dan de kracht van de energiebarrière. De ontsnappingssnelheid door mechanische kracht wordt bepaald door de grootte van de kracht en de massa van het molecuul.
Het vermogen van moleculen om aan kinetische vallen te ontsnappen is belangrijk voor een verscheidenheid aan biologische processen, waaronder het vouwen van eiwitten, het vouwen van RNA en de replicatie van DNA. Door de mechanismen te begrijpen waarmee moleculen aan kinetische vallen ontsnappen, kunnen we beter begrijpen hoe deze processen werken en hoe ze kunnen worden gereguleerd.
Hier zijn enkele specifieke voorbeelden van hoe moleculaire interacties het mogelijk maken om de energiebarrière te overwinnen:
* Bij het vouwen van eiwitten is het hydrofobe effect een belangrijke drijvende kracht achter de vorming van de gevouwen structuur. Het hydrofobe effect is de neiging van niet-polaire moleculen om samen in water te aggregeren. Deze neiging wordt veroorzaakt door het feit dat watermoleculen polair zijn en daarom waterstofbruggen met elkaar vormen. Wanneer niet-polaire moleculen omringd zijn door water, worden ze daarom uitgesloten van het water en aggregeren ze samen om hun contact met water te minimaliseren. Het hydrofobe effect kan helpen de energiebarrière voor het vouwen van eiwitten te overwinnen door de hydrofobe gebieden van het eiwit bij elkaar te brengen en een stabiele gevouwen structuur te vormen.
* Bij het vouwen van RNA is de waterstofbrug een belangrijke drijvende kracht achter de vorming van de gevouwen structuur. Waterstofbruggen worden gevormd tussen elektronegatieve atomen en waterstofatomen. In RNA worden waterstofbruggen gevormd tussen de stikstofatomen op de basen en de waterstofatomen op de suiker-fosfaatruggengraat. Waterstofbruggen kunnen helpen de energiebarrière voor het vouwen van RNA te overwinnen door de gevouwen structuur te stabiliseren.
* Bij DNA-replicatie is de basenparing tussen complementaire DNA-strengen een belangrijke drijvende kracht achter de vorming van de dubbele helix. Baseparing is de vorming van waterstofbruggen tussen de stikstofatomen op de basen van de ene DNA-streng en de waterstofatomen op de basen van de andere DNA-streng. Baseparing kan helpen de energiebarrière voor DNA-replicatie te overwinnen door de dubbele helix te stabiliseren.
Dit zijn slechts enkele voorbeelden van hoe moleculaire interacties het mogelijk maken de energiebarrière te overwinnen. Door de mechanismen te begrijpen waarmee moleculen aan kinetische vallen ontsnappen, kunnen we beter begrijpen hoe deze processen werken en hoe ze kunnen worden gereguleerd.
 Onderzoek onthult een nieuwe manier om chirale katalysatoren te maken
Onderzoek onthult een nieuwe manier om chirale katalysatoren te maken Welke stoffen zijn bijtender voor frisdranksap of azijn?
Welke stoffen zijn bijtender voor frisdranksap of azijn?  Wat is een uitgebalanceerde chemische vergelijking, waarom zou deze in evenwicht moeten zijn?
Wat is een uitgebalanceerde chemische vergelijking, waarom zou deze in evenwicht moeten zijn?  Helicaten ontmoeten rotaxanen om belofte te creëren voor toekomstige ziektebehandeling
Helicaten ontmoeten rotaxanen om belofte te creëren voor toekomstige ziektebehandeling Labelen en detecteren van RNA-modificaties
Labelen en detecteren van RNA-modificaties
 Wereldwijd rapport over plastic bedreigingen voor de oceaan
Wereldwijd rapport over plastic bedreigingen voor de oceaan Wereld staat voor onmogelijke taak bij klimaatbesprekingen na Parijs
Wereld staat voor onmogelijke taak bij klimaatbesprekingen na Parijs Ervan uitgaande dat gemakkelijke koolstofverwijdering uit de atmosfeer een gok met hoge inzetten is, wetenschappers zeggen:
Ervan uitgaande dat gemakkelijke koolstofverwijdering uit de atmosfeer een gok met hoge inzetten is, wetenschappers zeggen: Hoe biotische en abiotische factoren de denitrificatiesnelheid van sediment onder wetlandtypen reguleren
Hoe biotische en abiotische factoren de denitrificatiesnelheid van sediment onder wetlandtypen reguleren  Het verminderen van luchtvervuiling kan 50, 000 EU-sterfgevallen
Het verminderen van luchtvervuiling kan 50, 000 EU-sterfgevallen
Hoofdlijnen
- Zijn vissen de grootste atleten ter wereld?
- Kan het beschermen van onze eiwitten ons helpen veroudering te voorkomen?
- Hartmonitors op wilde narwallen onthullen alarmerende reacties op stress
- Wisseling van de wacht - onderzoek werpt licht op hoe planten ademen
- IJsberen verdringen op Russisch eiland in teken van Arctische verandering
- Wat hebben we geleerd van het Human Genome Project?
- Welke 2 systemen controleren de homeostase?
- Roofzuchtige bacteriën gevonden in studie van longmicrobioom van patiënten met cystische fibrose
- Gebruik van recombinant DNA in Agriculture
- In Australië worden zelfsteriliserende micronaalden ontwikkeld voor veiligere vaccinaties
- Materiaal voor nieuwe generatie atoomreactoren ontwikkeld

- 3D-grijswaarden digitaal licht printen (g-DLP) zeer functioneel gesorteerde materialen (FGM)

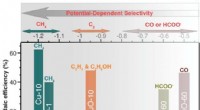
- Selectieve katalysatoren voor recycling van kooldioxide
- Microben maken die broeikasgassen transformeren

 Studie onthult radicale rimpel bij vorming van complexe koolstofmoleculen in de ruimte
Studie onthult radicale rimpel bij vorming van complexe koolstofmoleculen in de ruimte VISTA onthult een nieuwe afbeelding van de Grote Magelhaense Wolk
VISTA onthult een nieuwe afbeelding van de Grote Magelhaense Wolk Air France-KLM bestelt 60 nieuwe Airbus-vliegtuigen plannen A380 uitfasering
Air France-KLM bestelt 60 nieuwe Airbus-vliegtuigen plannen A380 uitfasering Vijf manieren om voedselverspilling terug te dringen, en waarom dit ertoe doet
Vijf manieren om voedselverspilling terug te dringen, en waarom dit ertoe doet  De onweersactiviteit is het hoogst aan de voet van de Zugspitze
De onweersactiviteit is het hoogst aan de voet van de Zugspitze Vrouwelijke leiders krijgen minder vaak steun dan mannen na grote terroristische aanslagen
Vrouwelijke leiders krijgen minder vaak steun dan mannen na grote terroristische aanslagen San Francisco mag politie verbieden, stadsgebruik van gezichtsherkenning
San Francisco mag politie verbieden, stadsgebruik van gezichtsherkenning Laboratoriumtechnieken aanpassen voor instructie op afstand
Laboratoriumtechnieken aanpassen voor instructie op afstand
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

