
Wetenschap
Onderzoekers ontwikkelen een onomkeerbare remmer om eiwitten aan te pakken die resistente mutaties hebben gekregen
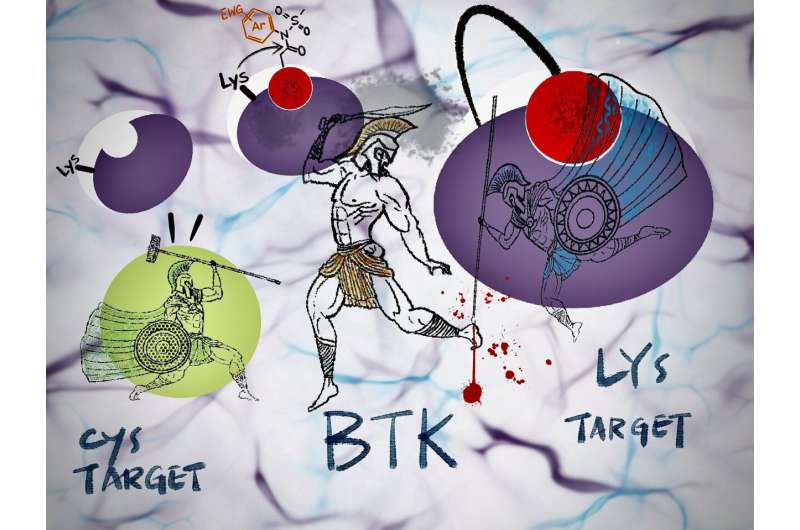
Het idee van onomkeerbare remmers die zich permanent aan een doeleiwit hechten, heeft steeds meer aandacht gekregen voor toepassing in de mogelijke ontwikkeling van geneesmiddelen. Een van de vele hindernissen is echter de mogelijkheid dat eiwitmutaties anders effectieve geneesmiddelen farmacologisch inactief maken.
De huidige covalente remmers hebben reactieve groepen waarvan bekend is dat ze een enkele reactie in doeleiwitten induceren, waardoor ze onomkeerbaar worden uitgeschakeld. Soms kunnen mutaties echter gemakkelijker optreden bij specifieke aminozuren, waardoor deze deactivering wordt verstoord.
Nu heeft een team van onderzoekers van de Universiteit van Kyoto een nieuwe reactant ontwikkeld die de werkzaamheid aantoont op eiwitten die resistente mutaties hebben gekregen.
"In Bruton-type tyrosinekinase (BTK), een belangrijk medicijndoelwit, is een mutatie waarbij aminozuren cysteïne in serine betrokken zijn - genaamd C481S - bekend, maar we hebben er nog geen gezien voor ons lysinedoelwit", merkt Tomonori Tamura van de Graduate op. Technische School.
"Toch is het veelbetekenend dat onze onomkeerbare remmer op zijn minst het C481S-probleem kan aanpakken", voegt Tamura toe.
Conventionele onomkeerbare remmers die in de klinische praktijk worden gebruikt, reageren alleen met proteïnecysteïneresiduen.
Bovendien is cysteïne – het meest reactieve van de twintig aminozuren – niet overvloedig aanwezig op reactie- of bindingsplaatsen. Dit aminozuur kan worden gemuteerd in een ander aminozuur, waardoor de op cysteïne gerichte onomkeerbare remmers niet effectief zijn tegen geneesmiddelenresistente eiwitten.
N-acyl-N-arylsulfonamide, of ArNASA, kan daarentegen reageren met lysineresiduen en is zeer stabiel in serumbevattende media en andere fysiologische omgevingen.
"Gebruikmakend van deze reactie-eigenschap hebben we de eerste onomkeerbare remmer van BTK ontwikkeld, die medicijnresistente mutaties heeft", voegt Tamura toe.
De jacht van het Tamura-team op bruikbare reactieve groepen kan met ArNASA vruchten afwerpen. Belangrijk is dat de elektrofielen beperkende factoren verwijderen door hydrolytische inactivatie en onbedoelde reacties met off-target-eiwitten te minimaliseren.
Zodra het doelwit in contact komt met de onomkeerbare remmer, reageert de reactieve groep chemisch met de aminozuren van het eiwit om een covalente binding te vormen. Er ontstaat een onverbiddelijke bindingsplaats, die de eiwitactiviteit onomkeerbaar remt.
Tamura's team verbeterde een eerdere NASA-groep – qua werkzaamheid vergelijkbaar met ArNASA maar ineffectief in serumbevattende media – door de nieuwe reactieve groep te synthetiseren met behulp van aromatische aminen als uitgangsmaterialen. De onderzoekers pasten de ArNASA-groep toe op BTK, een belangrijk therapeutisch doelwit voor bloedkankers zoals chronische lymfatische leukemie.
"Onze studie zal verder reiken dan celgebaseerd onderzoek naar in vivo, waardoor de weg wordt vrijgemaakt voor de ontwikkeling van medicijnen met diverse reactantgroepen die inwerken op specifieke aminozuren", besluit Tamura.
Het onderzoek is gepubliceerd in het Journal of the American Chemical Society .
Meer informatie: Masaharu Kawano et al, Lysine-reactieve N-Acyl-N-aryl Sulfonamide Kernkoppen:verbeterde reactie-eigenschappen en toepassing bij de covalente remming van een Ibrutinib-resistente BTK-mutant, Journal of the American Chemical Society (2023). DOI:10.1021/jacs.3c08740
Journaalinformatie: Journaal van de American Chemical Society
Aangeboden door de Universiteit van Kyoto
 Nieuw antischimmelmiddel van mierenboerderijen
Nieuw antischimmelmiddel van mierenboerderijen Wetenschappers bedenken snellere manier om antibiotica te ontdekken
Wetenschappers bedenken snellere manier om antibiotica te ontdekken Onderzoekers beschrijven een duurzamer proces om biobased polycarbonaten te recyclen
Onderzoekers beschrijven een duurzamer proces om biobased polycarbonaten te recyclen  Realisatie van kleurfiltervrije beeldsensoren
Realisatie van kleurfiltervrije beeldsensoren Spinout wil het testen van voedselveiligheid transformeren
Spinout wil het testen van voedselveiligheid transformeren
 Wat hebben de herten in het ecosysteem?
Wat hebben de herten in het ecosysteem?  We hebben snellere, betere manieren nodig om de afnemende riviergezondheid van Nieuw-Zeeland te monitoren, en het gebruik van milieu-DNA kan daarbij helpen
We hebben snellere, betere manieren nodig om de afnemende riviergezondheid van Nieuw-Zeeland te monitoren, en het gebruik van milieu-DNA kan daarbij helpen  Tsunami in Tohoku had invloed op de bouwgewoonten van eco-ingenieurshart-egels
Tsunami in Tohoku had invloed op de bouwgewoonten van eco-ingenieurshart-egels De verschillen tussen noordelijk en zuidelijk halfrond
De verschillen tussen noordelijk en zuidelijk halfrond Colombia verloor bosgebied ter grootte van Sao Paulo in 2019:rapport
Colombia verloor bosgebied ter grootte van Sao Paulo in 2019:rapport
Hoofdlijnen
- Een universeel raamwerk voor ruimtelijke biologie
- 3 Eigenschappen van een cel
- EU doorbreekt patstelling om licentie op controversiële onkruidverdelger te verlengen (update 3)
- Onderzoekers in Portugal ontwikkelen een AI-platform voor beeldanalyse om wereldwijd onderzoek te stimuleren
- Onthulling van natuurbeheerders:studie benadrukt de cruciale rol van aaseters in wetlands
- Evolutie door natuurlijke selectie:voorbeelden en effecten van aanpassing
- Kunnen we Neanderthalers terugbrengen?
- Genetica biedt de sleutel tot de strijd tegen doornenkroonzeesterren
- Eiwit beperkt de opname van sap door bladluizen
- Onderzoeksresultaten maken de weg vrij voor programmeerbare elektronische inkten

- Onderzoekers maken complexe molecule die spontaan vouwt als een eiwit
- Nieuw materiaal kan ademhalingsdruppels uit de lucht verwijderen

- Lipidedruppeltjes spelen een cruciale rol naast de opslag van vet
- Waarom tandpasta en cement na verloop van tijd uitharden?

 Een meer collectief begrip van de dynamiek en evolutie van kustsystemen
Een meer collectief begrip van de dynamiek en evolutie van kustsystemen Minderheden, allochtone bevolkingsgroepen werden geconfronteerd met verkeerde informatie, vijandigheid bij het online zoeken naar COVID-19-informatie
Minderheden, allochtone bevolkingsgroepen werden geconfronteerd met verkeerde informatie, vijandigheid bij het online zoeken naar COVID-19-informatie Bedreigende of obscene berichten ontvangen van een partner en geestelijke gezondheid
Bedreigende of obscene berichten ontvangen van een partner en geestelijke gezondheid Implantaat om hersenchemicaliën beter op te sporen na neurotrauma
Implantaat om hersenchemicaliën beter op te sporen na neurotrauma NASA, industrie verbeteren lidars voor verkenning, wetenschap
NASA, industrie verbeteren lidars voor verkenning, wetenschap  Tesla komt wanneer hij wordt gebeld, maar kan zenuwen rafelen
Tesla komt wanneer hij wordt gebeld, maar kan zenuwen rafelen Het mysterie van de grote G-controverse oplossen
Het mysterie van de grote G-controverse oplossen Een blik op door het klimaat veroorzaakte schade die zich ontvouwt in Perus Cordillera Blanca
Een blik op door het klimaat veroorzaakte schade die zich ontvouwt in Perus Cordillera Blanca
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

