
Wetenschap
Onderzoeker karakteriseert enzymen met N-N-bindingen voor antibacteriële toepassingen
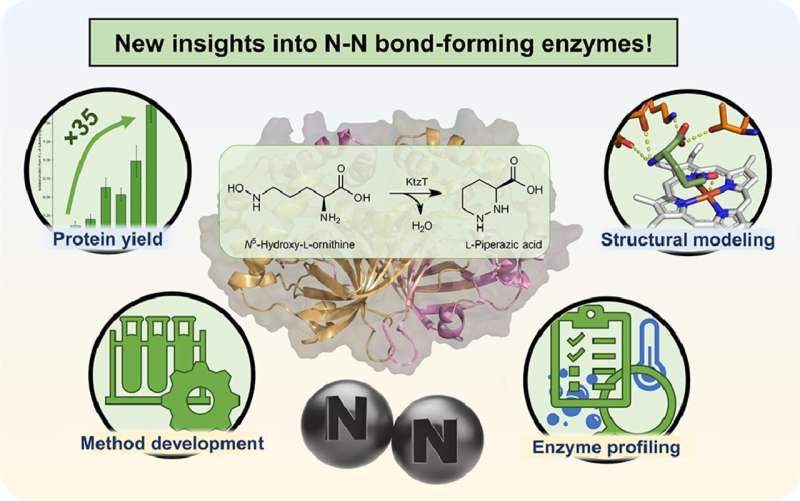
De bouwstenen voor nieuwe medicijnen die bacteriën helpen bestrijden die resistent zijn tegen bijvoorbeeld bekende antibiotica moeten zo kosteneffectief en milieuvriendelijk mogelijk zijn. Enzymen zijn hiervoor ideaal. Ze kunnen bijvoorbeeld verschillende componenten van actieve stoffen produceren of combineren.
In zijn masterscriptie bij de groep Microbiële Biotechnologie aan de Ruhr Universiteit Bochum karakteriseerde Simon Schröder een enzym in meer detail dat in staat is een gewenste stikstof-stikstofbinding in moleculen te vormen. Hij vond ook andere enzymen die dit kunnen doen. Het werk is gepubliceerd in het tijdschrift Molecular Catalysis .
Bouwstenen beperken het ontwerp van nieuwe werkzame stoffen
Onderzoekers zijn voortdurend in concurrentie met schadelijke micro-organismen die resistentie tegen antibiotica ontwikkelen. In de zoektocht naar nieuwe werkzame stoffen proberen ze traditioneel micro-organismen uit de natuur te isoleren die antibioticagedrag vertonen. Vervolgens identificeren ze de verantwoordelijke stoffen en bestuderen ze hun functie. Tegenwoordig wordt dit proces aangevuld met computerondersteunde methoden die het mogelijk maken om op maat gemaakte nieuwe moleculen te ontwerpen die specifieke effecten hebben op organismen en hun metabolische processen.
"Het ontwerp en de productie van dergelijke kunstmatige verbindingen wordt echter vaak beperkt door de precursormoleculen of bouwstenen die beschikbaar zijn voor de productie ervan", legt Schröder uit. Idealiter zou hun productieproces economisch en ecologisch moeten zijn, bijvoorbeeld door gebruik te maken van micro-organismen of hun katalytische enzymen. De uitbreiding van het modulaire systeem van beschikbare moleculen om nieuwe medicijnen te produceren is daarom navenant belangrijk en interessant.

De gewenste band gemakkelijker toegankelijk maken
"We werken aan de productie van een specifiek type van dergelijke moleculen", legt Schröder uit. In 2017 werd een enzym geïsoleerd dat de stikstof-stikstofbinding in moleculen kan vormen, wat zelden in de natuur voorkomt. Er is echter nog heel weinig bekend over dit enzym met de systematische naam "KtzT":hoe werkt het? In welke verbindingen kan het deze binding vormen? Is het geschikt om farmaceutisch relevante moleculen te produceren?
"Aanvankelijk konden we de productie en isolatie van dit enzym in het laboratorium met een factor 35 verbeteren", meldt Schröder. "Dit stelde ons in staat KtzT te karakteriseren, d.w.z. de optimale reactieomstandigheden te identificeren:bij welke temperatuur, welke pH-waarde werkt het het beste en hoe stabiel is het onder een breed scala aan omstandigheden?"
Het onderzoeksteam heeft ook KtzT-achtige enzymen gevonden en geïsoleerd en aangetoond dat ze ook de reactie kunnen katalyseren. "We konden ook een meerstapsreactie met verschillende enzymen implementeren, waardoor de stikstof-stikstofbinding nog gemakkelijker toegankelijk werd", zegt Schröder.
Hij gebruikte onder meer bio-informaticamethoden om een structureel model van het enzym te ontwikkelen, waarmee hypothesen kunnen worden opgesteld over het reactiemechanisme en het enzym specifiek kan worden aangepast, zodat het ook in andere verbindingen de stikstof-stikstofbinding kan vormen.
Meer informatie: Simon Schröder et al, Verbetering van de vorming van biokatalytische N-N-bindingen met het actinobacteriële piperazaatsynthase KtzT, Moleculaire katalyse (2023). DOI:10.1016/j.mcat.2023.113733
Aangeboden door Ruhr-Universitaet-Bochum
 Algoritme voor machinaal leren helpt bij het zoeken naar nieuwe medicijnen
Algoritme voor machinaal leren helpt bij het zoeken naar nieuwe medicijnen Eeuwenoud probleem opgelost met allereerste 3D-atomaire beeldvorming van een amorfe vaste stof
Eeuwenoud probleem opgelost met allereerste 3D-atomaire beeldvorming van een amorfe vaste stof Smeltpunten van metalen versus niet-metalen
Smeltpunten van metalen versus niet-metalen  Het ion vormen dat het universum heeft gemaakt
Het ion vormen dat het universum heeft gemaakt Wetenschappers verklaren het fenomeen pseudocapaciteit in supercondensatoren
Wetenschappers verklaren het fenomeen pseudocapaciteit in supercondensatoren
 allergieën, gletsjers, en pikas:klimaatverandering in actie
allergieën, gletsjers, en pikas:klimaatverandering in actie Wetenschappelijke experimentideeën voor AP Biologie
Wetenschappelijke experimentideeën voor AP Biologie Riffen beschermen kwetsbare Caribische vissen tegen klimaatverandering
Riffen beschermen kwetsbare Caribische vissen tegen klimaatverandering Irma voorspelt dat het dagenlang een krachtige orkaan blijft
Irma voorspelt dat het dagenlang een krachtige orkaan blijft Gebouwen gemaakt van hout in plaats van cement en staal kunnen belangrijke wereldwijde koolstofputten zijn
Gebouwen gemaakt van hout in plaats van cement en staal kunnen belangrijke wereldwijde koolstofputten zijn
Hoofdlijnen
- De effecten van zoutconcentratie op bacteriegroei
- Australische politie jaagt op moordenaar van gigantische krokodil
- Hands-on Science-activiteiten over bloed
- Groter en levensechter:wat is de toekomst van bioprinted organen?
- Het ontsluiten van de geheimen van interacties tussen planten en elektromagnetische velden:een uitgebreid overzicht
- De effectiviteit van camouflage bij verschillende dieren vergelijken
- Onderzoekers identificeren de gistgenen achter rozen- en honingaroma's in bier en wijn
- Hoe de lengte van DNA-fragmenten
- Wat is het voordeel van het gebruik van vlekken om naar cellen te kijken?
- Wetenschappers krijgen een voorproefje van een belangrijk proces in de levensduur van de batterij
- Een ontbrekende schakel van methaan naar methanol blootleggen

- Energieonderzoekers vinden kameleonmetaal uit dat zich gedraagt als vele anderen

- Metaalvrije katalysator breidt het bereik van estersynthese uit
- Een nieuwe manier om moleculen te maken voor de ontwikkeling van geneesmiddelen

 Een vergrendelingscombinatie ophalen
Een vergrendelingscombinatie ophalen Kinderen studeren in oververhitte sloppenwijken terwijl de Filipijnen scholen sluiten
Kinderen studeren in oververhitte sloppenwijken terwijl de Filipijnen scholen sluiten  Orbitale variaties van de aarde en synchrone ijstijden op zee-ijs
Orbitale variaties van de aarde en synchrone ijstijden op zee-ijs Opnieuw beoordelen wat we van peptiden kunnen verwachten bij de detectie van ziekten
Opnieuw beoordelen wat we van peptiden kunnen verwachten bij de detectie van ziekten  Nieuwe sensor om de bewaking van de ademhaling op de intensive care te verbeteren
Nieuwe sensor om de bewaking van de ademhaling op de intensive care te verbeteren Waarom verandert glas paars?
Waarom verandert glas paars?  De volgende Volle Maan is de Roze Maan
De volgende Volle Maan is de Roze Maan  Klimaatverandering brengt branden, overstromingen en motten naar Siberië
Klimaatverandering brengt branden, overstromingen en motten naar Siberië
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

