
Wetenschap
Een nieuwe multifunctionele katalysator zet methaan om in waardevolle koolwaterstoffen
Methaan, een broeikasgas dat aanzienlijk bijdraagt aan de opwarming van de aarde, is ook een belangrijke energiebron en een essentiële chemische hulpbron. Bij gebruik als chemische grondstof wordt methaan doorgaans eerst omgezet in methanol en vervolgens in koolwaterstoffen. Deze sequentiële conversie vereist echter complexe industriële opstellingen. Belangrijker nog is dat, aangezien methaan een zeer stabiel molecuul is, de omzetting ervan in methanol enorme hoeveelheden energie vergt bij gebruik van conventionele middelen, zoals het reformen van methaan met stoom.
Tegen deze achtergrond heeft de katalytische omzetting van methaan in methanol of andere chemicaliën veel aandacht getrokken van wetenschappers, die graag energie-efficiëntere en duurzamere oplossingen willen vinden. Van de onlangs gerapporteerde katalysatoren zijn koper (Cu)-bevattende zeolieten veelbelovend gebleken voor de omzetting van methaan in methanol onder milde omstandigheden. Helaas zijn de opbrengst en selectiviteit van de meeste gerapporteerde katalysatoren laag, wat betekent dat naast methanol grote hoeveelheden ongewenste bijproducten worden gegenereerd.
Dat blijkt uit een recente studie gepubliceerd in Nature Communications onderzocht een onderzoeksteam, waaronder universitair hoofddocent Toshiyuki Yokoi van het Tokyo Institute of Technology, Japan, een nieuw type bifunctionele zeolietkatalysator. Interessant is dat deze Cu-bevattende, op aluminosilicaat gebaseerde zeoliet in staat is methaan en distikstofoxide, een ander broeikasgas, rechtstreeks om te zetten in waardevolle verbindingen via een reeks tussenreacties.
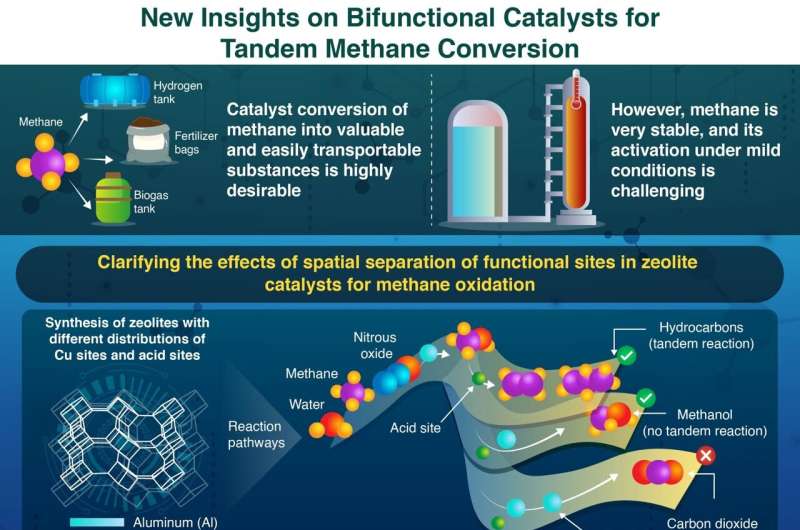
Een van de belangrijkste vragen die de onderzoekers beantwoordden, was hoe de ruimtelijke verdeling van verschillende actieve locaties in de katalysator de output van de reacties beïnvloedde. Daartoe hebben ze meerdere katalysatoren gemaakt, waarbij ze niet alleen gebruik maakten van verschillende concentraties Cu- en zuurplaatsen (protonen) in waterige oplossingen, maar ook van verschillende fysische mengtechnieken voor vaste monsters.
Via verschillende experimentele en analytische technieken ontdekten de onderzoekers dat de nabijheid tussen Cu- en zuurlocaties cruciaal was voor het bepalen van de eindproducten. Meer specifiek rapporteerden ze dat wanneer Cu-locaties zich dicht bij elkaar bevonden, de methanol die op Cu-locaties uit methaan werd geproduceerd een grotere kans had om overoxideerd te worden door een aangrenzende Cu-locatie, waardoor het in kooldioxide veranderde. Wanneer Cu-locaties en zure locaties zich daarentegen dicht bij elkaar bevonden, reageerde methanol in plaats daarvan met lachgas op een aangrenzende zure locatie, waardoor waardevolle koolwaterstoffen en onschadelijk stikstofgas ontstonden.
"We concludeerden dat het voor een stabiele en efficiënte productie van methanol en uiteindelijk bruikbare koolwaterstoffen uit methaan noodzakelijk is om Cu-sites en zure sites uniform te verdelen en ze op gepaste afstand van elkaar te laten staan", legt Yokoi uit. "We ontdekten ook dat de verdeling van de verkregen producten ook wordt beïnvloed door de zuureigenschappen en de poriënstructuur van de zeolietkatalysator."
Een van de meest opvallende voordelen van de voorgestelde katalysator is het vermogen om tandemreacties in stand te houden, dat wil zeggen een eenvoudig proces dat meerdere stappen in één samenvoegt en tegelijkertijd twee verschillende schadelijke broeikasgassen verwijdert. Deze eigenschap zal van cruciaal belang zijn om dergelijke katalytische systemen aantrekkelijk te maken in een industriële omgeving.
"Ons werk zal hopelijk een leidraad zijn voor toekomstige inspanningen om methaanoxidatie tot methanol te bereiken en mogelijkheden te openen voor het bevorderen van de koolwaterstofsynthese met behulp van methanol als tussenproduct", besluit Yokoi.