
Wetenschap
Drie begeleiders coördineren het uiteenvallen van amyloïde fibrillen in gist
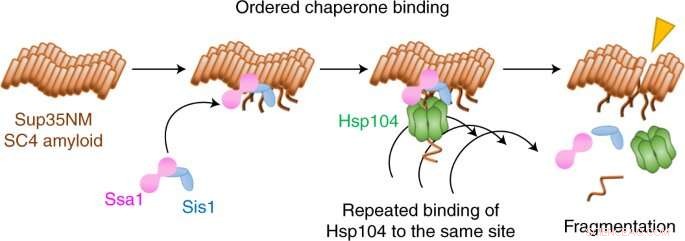
Credit:Yoshiko Nakagawa et al, Nature Chemical Biology (2022). DOI:10.1038/s41589-021-00951-y
In een bevinding die belangrijke gevolgen heeft voor neurodegeneratieve aandoeningen zoals de ziekte van Alzheimer, hebben RIKEN-onderzoekers ontdekt hoe drie chaperonne-moleculen in gistcellen samenwerken om bèta-sheet-rijke fibrillaire eiwitaggregaten, bekend als amyloïde fibrillen, af te breken.
Eiwitten die op de verkeerde manier zijn gevouwen, kunnen hun werk niet goed doen. Sommige verkeerd gevouwen eiwitten, bekend als prionen, zijn bijzonder verraderlijk omdat ze hun vervormde vormen doorgeven aan de eiwitten om hen heen, die vervolgens in elkaar grijpen om robuuste vlotten te vormen die amyloïde fibrillen worden genoemd. Amyloïde fibrillen zijn betrokken bij prionziekten (zoals de ziekte van Creutzfeldt-Jakob), die altijd dodelijk zijn, en neurodegeneratieve aandoeningen zoals de ziekte van Alzheimer en Parkinson.
Het proces waarbij amyloïde fibrillen worden gevormd heeft veel aandacht gekregen, maar er is veel minder bekend over het mechanisme waarmee ze in cellen worden afgebroken. Dit desaggregatieproces is belangrijk omdat de fragmenten die het produceert ervoor kunnen zorgen dat prionen zich tussen cellen kunnen verspreiden.
"Veel onderzoekers hebben het vormingsmechanisme van amyloïde fibrillen onderzocht, maar er zijn zeer weinig studies gedaan naar de desaggregatie van amyloïde", zegt Motomasa Tanaka van het RIKEN Center for Brain Science. "De kleine eiwitfragmenten dienen echter als zaden voor de vorming van amyloïde fibrillen elders, en eerder werk door ons suggereert dat amyloïde desaggregatie eigenlijk belangrijker is dan de groei van amyloïde fibrillen."
Als we weten hoe amyloïde fibrillen worden afgebroken, kunnen onderzoekers ook behandelingen voor prion- en neurodegeneratieve ziekten ontwikkelen.
Nu hebben Yoshiko Nakagawa, Tanaka en collega's een vorm van fluorescentiemicroscopie met één molecuul gebruikt om te filmen hoe drie moleculen coördineren om amyloïde fibrillen op te breken in een prionsysteem in gist.
Ze ontdekten dat het uiteenvallen begint met twee chaperonnes, Hsp70 en Hsp40, die de grond voorbereiden door zich aan de fibril te binden. Een derde chaperonne, Hsp104, hakt vervolgens de fibril weg door zich herhaaldelijk aan dezelfde plaats te binden.
Interessant is dat het team ontdekte dat naast dit fragmentatiemechanisme een ontbindingsmechanisme ook fibrillen verbreekt, maar door een heel andere chaperonne-choreografie. Welk mechanisme optreedt, hangt af van de moleculaire vorm, of bevestiging, van de fibril.
Er waren veel verrassingen in deze studie, merkt Tanaka op. "We hadden niet verwacht dat Hsp104 zich zo vaak aan dezelfde plaats hecht om amyloïde fibrillen te fragmenteren", zegt hij. "En de desaggregatiemodi voor de twee verschillende fibrilbevestigingen zijn heel verschillend:het fragmentatiemechanisme produceerde veel kleine fragmenten, terwijl de amyloïde vezelfluorescentie geleidelijk verdween voor het oplossingsmechanisme."
Het team is van plan de mechanismen in meer detail te onderzoeken en in de toekomst hopen ze atomaire resolutie te bereiken. + Verder verkennen
De mysteries rond diabetes type 2 ontrafelen
 Klimaatvriendelijke landbouwstrategieën kunnen het land verbeteren en inkomsten genereren voor boeren
Klimaatvriendelijke landbouwstrategieën kunnen het land verbeteren en inkomsten genereren voor boeren Het zal moeilijk zijn, maar we kunnen de wereld voeden met plantaardig eiwit
Het zal moeilijk zijn, maar we kunnen de wereld voeden met plantaardig eiwit Afbeelding:Maak kennis met de grootste ijsberg ter wereld
Afbeelding:Maak kennis met de grootste ijsberg ter wereld Zuidpool warmt drie keer sneller op dan de rest van de aarde:studie
Zuidpool warmt drie keer sneller op dan de rest van de aarde:studie Sensoren aangedreven door machine learning sporen gaslekken snel op
Sensoren aangedreven door machine learning sporen gaslekken snel op
Hoofdlijnen
- Wat is een organel in een cel?
- Klimaatverandering maakt baardagamen mogelijk minder intelligent
- Cambodja neemt lading ivoor in beslag, verborgen in holle boomstammen
- Tips voor bedwantsen voor vakantiereizigers
- Genoom van tarwe-voorouder gesequenced
- De methoden van inventarisatie in Microbes
- Netwerken gebruiken om weefselspecifieke genregulatie te begrijpen
- Genetici ontdekken nieuwe ondersoorten van wilde geiten via oud DNA
- Wat is een gen,
- Natuurkundigen krijgen nieuwe inzichten in nanosystemen met bolvormige opsluiting

- Boomringen gebruikt om smokkelaarsringen tegen te gaan

- Onderzoekers kijken naar manieren om standaard remsystemen te verbeteren

- Rundvleespeptiden blokkeren bittere smaken
- Nauwkeurig gedefinieerde polymeerketens nu een realiteit

 Nog twee satellieten voegen zich bij de werkende constellatie van Galileo
Nog twee satellieten voegen zich bij de werkende constellatie van Galileo Woedende bosbrand treft Duitse dorpen
Woedende bosbrand treft Duitse dorpen Een verrassende reeks klimaatgebeurtenissen kan jaren van tevoren voorspelbaar zijn
Een verrassende reeks klimaatgebeurtenissen kan jaren van tevoren voorspelbaar zijn Een lichte aardbeving schudt Rome wakker, nog geen schade bekend
Een lichte aardbeving schudt Rome wakker, nog geen schade bekend Chemici worden moleculaire beeldhouwers, het synthetiseren van kleine, moleculaire vallen
Chemici worden moleculaire beeldhouwers, het synthetiseren van kleine, moleculaire vallen Iets verkopen? Speel in op de arrogantie van de consument
Iets verkopen? Speel in op de arrogantie van de consument In een handomdraai van isolator naar geleider
In een handomdraai van isolator naar geleider Wat zijn de negatieve effecten van natuurrampen?
Wat zijn de negatieve effecten van natuurrampen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

