
Wetenschap
Proces om moleculen aan te passen doet dubbel werk

Rice University afgestudeerde student Kang-Jie (Harry) Bian zet lichtgevoelige moleculen op voor een experiment in het laboratorium van chemicus Julian West. Bian is hoofdauteur van een studie die is geïnspireerd op natuurlijke processen om de modulaire difunctionalisatie van alkeenmoleculen voor het ontwerpen van geneesmiddelen en materialen mogelijk te maken. Krediet:Rice University
Geïnspireerd door je lever en geactiveerd door licht, is een chemisch proces ontwikkeld in laboratoria van Rice University en in China veelbelovend voor het ontwerpen van medicijnen en de ontwikkeling van unieke materialen.
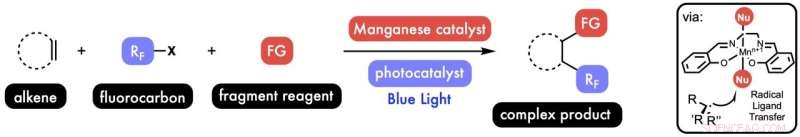
Onderzoekers onder leiding van Rice-chemicus Julian West en Xi-Sheng Wang van de Universiteit voor Wetenschap en Technologie van China, Hefei, rapporteren hun succesvolle katalytische proces om gelijktijdig twee verschillende functionele groepen toe te voegen aan enkele alkenen, organische moleculen afkomstig uit petrochemicaliën die ten minste één koolstof-koolstof dubbele binding gecombineerd met waterstofatomen.
Beter nog, zeggen ze, is dat deze alkenen "niet-geactiveerd" zijn - dat wil zeggen, ze missen reactieve atomen in de buurt van de dubbele binding - en tot nu toe een uitdaging gebleken om te verbeteren.
De chemische route beschreven in het Journal of the American Chemical Society zou de oprichting van een bibliotheek van voorlopers voor de farmaceutische industrie kunnen vereenvoudigen en de productie van polymeren kunnen verbeteren.
West, wiens laboratorium synthetische chemische processen ontwerpt, zei dat de eerste inspiratie afkomstig was van een enzym, cytochroom P450, dat de lever gebruikt om potentieel schadelijke moleculen te elimineren.
"Deze enzymen zijn een soort buzzsaws die moleculen vermalen voordat ze je in de problemen kunnen brengen," zei hij. "Ze doen dit via een interessant mechanisme dat radicale rebound wordt genoemd."
West zei dat P450 koolstof-waterstofbindingen vindt en de waterstof verwijdert, waardoor een koolstof-gecentreerde radicaal achterblijft die een ongepaard elektron bevat.
"Dat elektron wil echt een partner vinden, dus de P450 zal onmiddellijk een zuurstofatoom teruggeven (de 'rebound'), waardoor het molecuul wordt geoxideerd," zei hij. "In het lichaam helpt dat om deze moleculen te deactiveren, zodat je ze kwijt kunt raken.
"Dit soort rebound is krachtig", zei West. "En Harry (hoofdauteur Kang-Jie Bian, een afgestudeerde Rice-student) vroeg zich af of we zoiets konden doen om verschillende fragmenten op die radicaal over te brengen."
De chemici van Rice University ontwikkelden een methode om in één proces twee fragmenten aan een alkeenmolecuul toe te voegen. De ontdekking zou het ontwerp van medicijnen en materialen kunnen vereenvoudigen. Krediet:West Research Group/Rice University
Hun oplossing was om wat zij radicale ligandoverdracht noemen mogelijk te maken, een algemene methode die mangaan gebruikt om de 'radicale rebound' te katalyseren.
West zei dat terwijl P450 het nabijgelegen element ijzer gebruikt om de biologische reactie te katalyseren, eerdere experimenten in het Rice-lab en elders hebben aangetoond dat mangaan potentieel had.
"Mangaan hielp het proces selectiever en een beetje actiever te zijn, maar ook veel goedkoper en gemakkelijker", legde hij uit. "Het kan een heleboel verschillende atomen overbrengen, zoals chloor, stikstof en zwavel, gewoon door te veranderen welk commercieel ingrediënt je aan de reactie toevoegt."
Die reactie zorgde voor één functionalisering. Waarom niet voor twee gaan?
West zei dat Bian ook op het idee kwam om een fotokatalysator aan de mix toe te voegen. "Als je er licht op laat schijnen, wordt het opgewonden en kun je dingen doen die in de grondtoestand onmogelijk zouden zijn, zoals het activeren van kleine fluorkoolstofmoleculen om radicale fragmenten te maken met koolstof-fluorbindingen, die belangrijk zijn voor de farmaceutische en materiaalwetenschap, " hij zei. "Nu kunnen we deze hechten aan ons molecuul van belang."
Het eindresultaat is een mild en modulair proces om in één stap twee functionele groepen aan één alkeen toe te voegen.
"Eerst hebben we de koolstof-koolstof dubbele binding van een molecuul van belang, het alkeen," zei West, samenvattend. "Dan voegen we deze waardevolle fluorkoolstof toe, en dan zwemt de mangaankatalysator omhoog en voert deze radicale ligandoverdracht uit om een chloor- of stikstof- of zwavelatoom toe te voegen."
Hij merkte op dat de samenwerking tussen Rice en Wang's lab een natuurlijk gevolg was van Bian's verhuizing naar Rice vanuit Hefei, waar hij zijn masterdiploma behaalde. "We hebben ons echt gericht op het mangaanaspect van dit werk, en de groep van Wang bracht niet alleen expertise in fotokatalyse mee, maar ontwikkelde en testte ook koolstoffluorfragmenten, en toonde aan dat ze heel goed zouden werken in dit systeem," zei West.
Hij zei dat naast de farmaceutische en materiaalwetenschappen ook de chemische biologie baat zou kunnen hebben bij het proces, vooral vanwege de affiniteit met pClick, een methode die door Rice-chemicus Han Xiao is ontdekt om medicijnen of andere stoffen aan antilichamen te hechten.
Co-auteurs zijn Rice undergraduate David Nemoto Jr. en graduate student Shih-Chieh Kao, en Yan He en Yan Li van Hefei. Wang is een professor aan Hefei. West is de Norman Hackerman-Welch Young Investigator en een assistent-professor scheikunde. + Verder verkennen
Haast om medicijnen te ontwikkelen? Hier is je chat
Hoofdlijnen
- Ponso helpen, enige overlevende van Chimpansee-eiland in I. Coast
- Dit is waarom Fortnite zo verslavend is
- Vergelijking van klonen met mitose
- De ellende van Merkel neemt toe als minister van Landbouw orders negeert (update)
- Een verticale laminaire luchtstromingskap reinigen
- Het voorspellen van migratieroutes van muilezelherten zonder GPS-halsbanden
- Hoe stuifmeel werkt
- Bloedbad vreest race om zeldzame Australische papegaai te redden
- Studie onderzoekt de impact van leeuwen die naast giraffenpopulaties leven
- Dunne huid:Japanse firma ontwikkelt ultrafijn spray-on gezichtsmasker

- Moleculaire sonde brengt verkeerd gevouwen proteoomstatus in levende cellen in kaart
- Epoxyharsen:uitharden met een druk op de knop

- Vloeibaar platina bij kamertemperatuur:de koele katalysator voor een duurzame revolutie in de industriële chemie

- Zeewater thuis repliceren

 Uber begint bijna 7% onder de IPO-prijs te handelen
Uber begint bijna 7% onder de IPO-prijs te handelen NASA vindt Nadine een compacte tropische storm
NASA vindt Nadine een compacte tropische storm De oude krokodil die op dinosaurussen jaagde
De oude krokodil die op dinosaurussen jaagde SpaceX heeft zojuist een superheld-ontwerpteam ingehuurd voor zijn ruimtepakken
SpaceX heeft zojuist een superheld-ontwerpteam ingehuurd voor zijn ruimtepakken  Techreuzen beloven tegen 2022 het aantal vrouwelijke managers te verdubbelen
Techreuzen beloven tegen 2022 het aantal vrouwelijke managers te verdubbelen Vuurstrepen ontstaan bij botsingen van atoomkernen
Vuurstrepen ontstaan bij botsingen van atoomkernen Hoe high-tech stoffen je lichaam zullen transformeren
Hoe high-tech stoffen je lichaam zullen transformeren  Brexit:de landbrug van Ierland naar het continent verhoogt de luchtvervuiling in het VK
Brexit:de landbrug van Ierland naar het continent verhoogt de luchtvervuiling in het VK
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


