
Wetenschap
Prionen:nieuw mogelijk therapeutisch doelwit ontdekt
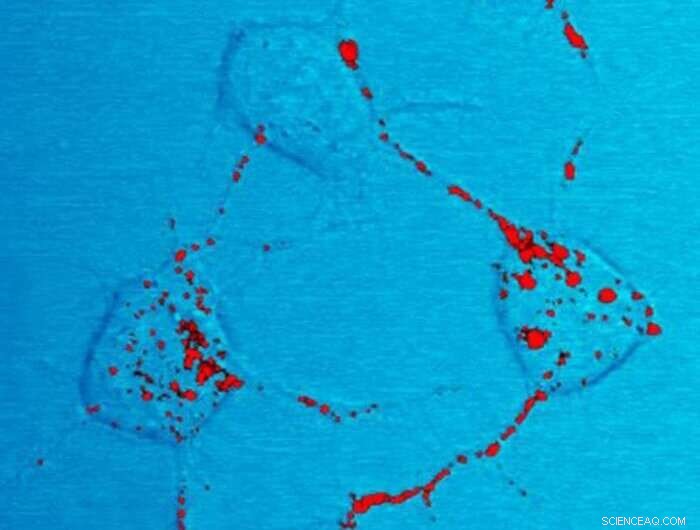
prionen. Krediet:National Institute of Health
Prionziekten, zoals boviene spongiforme encefalopathie ("gekkekoeienziekte"), zijn dodelijke neurodegeneratieve infectieziekten die mensen en andere zoogdieren treffen en waarvoor momenteel geen genezing bestaat.
Deze ziekten worden veroorzaakt door de ophoping van prionen, dit zijn verkeerd gevouwen versies van eiwitten die van nature in onze hersenen aanwezig zijn. Nieuw onderzoek onder leiding van Giuseppe Legname van SISSA en Roberto Fattorusso van de Universiteit van Campania "Luigi Vanvitelli", en onlangs gepubliceerd in Chemical Science , duikt in het moleculaire mechanisme dat ervoor zorgt dat prioneiwitten hun pathologische vorm aannemen:een ontdekking die de weg vrijmaakt voor mogelijke therapeutische opties.
Prionen zijn gewijzigde (d.w.z. verkeerd gevouwen) vormen van het cellulaire prioneiwit (PrPC) dat voornamelijk in onze hersenen aanwezig is. Deze infectieuze agentia kunnen de oorspronkelijke versie van het prioneiwit in een pathologische vorm veranderen. De accumulatie van prionen in hersengebieden is de oorzaak van prionziekten, dit zijn snel progressieve neurodegeneratieve ziekten die zowel mensen als andere dieren treffen.
Met name de replicatie van prionen in de hersenen creëert kleine belletjes die leiden tot de vorming van microscopisch kleine gaatjes waardoor het hersenweefsel op een spons lijkt, vandaar de naam spongiforme encefalopathie. Prionziekten worden gekenmerkt door een geleidelijke afname van cognitieve vaardigheden en motorische functies, die uiteindelijk tot de dood leiden.
Hoewel er talloze experimentele en theoretische onderzoeken zijn uitgevoerd, was het moleculaire mechanisme dat de verandering in de prionstructuur van fysiologisch naar pathologisch reguleert, tot nu toe weinig bekend.
"Om ons te verdiepen in de dynamiek die dit mechanisme reguleert, hebben we geavanceerde multidimensionale experimenten met nucleaire magnetische resonantie (NMR) uitgevoerd, uitgevoerd door Luigi Russo van de afdeling Biologische en Farmaceutische Milieuwetenschappen en Technologieën van de Universiteit van Campania", legt Roberto Fattorusso uit, coördinator van de studie gepubliceerd in Chemical Science .
"Dankzij multidisciplinaire experimentele benaderingen, variërend van structurele biologie tot celbiologie," vervolgt Fattorusso, "was het mogelijk om belangrijke nieuwe details te ontdekken over de moleculaire basis van prionziekten." Giulia Salzano, een voormalige SISSA Ph.D. student en momenteel een postdoc aan de Human Technopole in Milaan, Italië, nam ook deel aan het werk.
Het was daarom mogelijk om de structuur van het menselijke prioneiwit te benadrukken, dat een intermediair is tussen de fysiologische en pathologische celvormen.
"Dankzij deze ontdekking zal het nu mogelijk zijn om nieuwe organische moleculen te ontwerpen, en bijgevolg nieuwe medicijnen, die in staat zijn om de overgang van het prioneiwit van de fysiologische naar de pathologische vorm te blokkeren, waardoor de replicatie van prionen wordt voorkomen. Dit is een zeer belangrijke stap voorwaarts in de strijd tegen deze familie van neurodegeneratieve ziekten waarvoor nog geen genezing bestaat", legt Giuseppe Legname uit, directeur van het laboratorium voor prionbiologie bij SISSA, die ook de studie coördineert. + Verder verkennen
Beschadigde eiwitten in beeld:hoe vorm aanleiding geeft tot variaties van dodelijke hersenziekte
 Miljoenen blootgesteld aan potentieel gevaarlijke metalen, nieuwe technologie kan het risico helpen verlagen
Miljoenen blootgesteld aan potentieel gevaarlijke metalen, nieuwe technologie kan het risico helpen verlagen DNA buigen kost minder energie dan aangenomen
DNA buigen kost minder energie dan aangenomen Lijst van positieve en negatieve ionen
Lijst van positieve en negatieve ionen Hyper-CEST NMR-techniek onthult ontbrekende structuur van een nieuw containermolecuul
Hyper-CEST NMR-techniek onthult ontbrekende structuur van een nieuw containermolecuul Op weg naar verbeterde wondgenezing:chemische synthese van een trefoil-factorpeptide
Op weg naar verbeterde wondgenezing:chemische synthese van een trefoil-factorpeptide
Hoofdlijnen
- Wat is een geest? Onderzoeker daagt percepties van gevoel uit met de kleinste wezens
- Zwaarlijvige honden geholpen door effectieve gewichtsverliesproeven
- Mannelijke mammoeten vielen vaker in natuurlijke vallen en stierven, DNA-bewijs suggereert:
- Vermont ziet hedendaags record voor reproductie van Amerikaanse zeearenden
- Hoe Ninja-deeltjes werken
- Hoe maak je een DNA-model van kralen en rietjes
- Toch niet zo verschillend:menselijke cellen, winterharde microben delen een gemeenschappelijke voorouder
- Zijn leefgebied is gedecimeerd, deze charismatische vogel uit Minnesota danst op de rand van de vergetelheid
- 25 nieuwe genomen om 25 jaar Sanger Institute te vieren
- MOF's kunnen lastige gassen detecteren en sorteren

- Nieuwe katalysator verhoogt de elektroreductie van kooldioxide tot multicarbon-producten
- Nieuw materiaal kan giftige stoffen uit de lucht opvangen

- Huidpleister kan pijnloos vaccins afgeven, kankermedicatie in één minuut

- Ontkoppeling van elektronisch en thermisch transport

 SpaceXs moment van triomf komt aan als astronauten klaar zijn voor lancering in de VS
SpaceXs moment van triomf komt aan als astronauten klaar zijn voor lancering in de VS Frankrijk positief na gesprekken met Duitsland over digitale belasting
Frankrijk positief na gesprekken met Duitsland over digitale belasting Een kosteneffectieve methode om chemische bouwstenen te synthetiseren
Een kosteneffectieve methode om chemische bouwstenen te synthetiseren Armoede verslechterde 2020 omdat veel laagbetaalde arbeiders de dupe werden van de economische klappen
Armoede verslechterde 2020 omdat veel laagbetaalde arbeiders de dupe werden van de economische klappen Biologische producten promoten bij consumenten
Biologische producten promoten bij consumenten Voorbeelden van katrollen in de dagelijkse levensduur
Voorbeelden van katrollen in de dagelijkse levensduur De andere virusbedreiging:toename van cyberaanvallen met COVID-thema
De andere virusbedreiging:toename van cyberaanvallen met COVID-thema Piloten hebben in de VS problemen gemeld met nieuwe Boeing-jet
Piloten hebben in de VS problemen gemeld met nieuwe Boeing-jet
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

