Wetenschap
Het vergelijken van cryogene structuren met monsters op kamertemperatuur kan helpen bij het identificeren van fouten in rekenmodellen
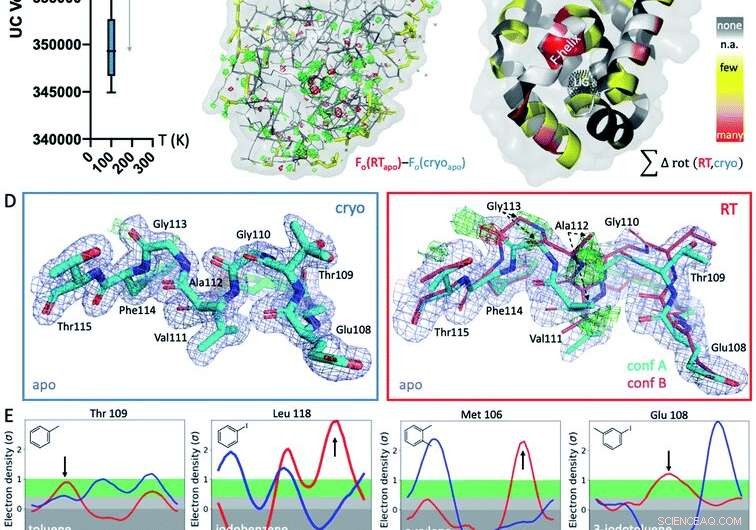
Fig. 1 Globale en lokale structurele reacties op temperatuur. (A) Wereldwijd, structuren bij cryogene temperaturen (cryo; blauwe grafiek) zijn meer variabel en compacter dan hun equivalenten bij kamertemperatuur (RT; rode grafiek), zoals blijkt uit gemiddelde eenheidscel (UC) volumes over 9 gematchte structuren verzameld bij beide temperaturen. (B) De isomorfe Fo − Fo-kaart van de apo-structuur verzameld bij cryo versus RT toont verschillen in de elektronendichtheid (groen gaas, positief verschil elektronendichtheid; rood gaas, negatief verschil elektronendichtheid) die wijzen op idiosyncratische temperatuureffecten, vooral rond de ligandbindingsplaats in de onderkwab, aangegeven door het zwarte gestippelde gaas in paneel C (aangeduid met LIG). (C) Het optreden van temperatuurafhankelijke rotameerverschillen in alle 9 structuren wordt geprojecteerd op de respectieve residuen in de T4L apo-structuur; gekleurd door temperatuurgevoeligheid van elk residu over alle 9 structuurparen:geel voor enkele structuren, oranje voor verschillende structuren, en rood voor de meeste structuren die temperatuurverschillen van het residu laten zien; witte vlekken zijn Gly en Ala die geen Chi-hoeken hebben; en grijze vlekken vertonen geen rotameerverandering met temperatuur. (D) Lokaal, RT-gegevens van de L99A apo-holte onthullen een alternatieve F-helix-conformatie (conf. B) in de Fo − Fc-verschilelektronendichtheidskaarten (groen en rood gaas voor positieve en negatieve dichtheid, respectievelijk; alleen cyaan conformatie A werd meegenomen in verfijning) die niet zichtbaar is bij cryo; 2mFo − DFc-kaart weergegeven als blauw gaas; stokdikte vertegenwoordigt relatieve bezetting. (E) Alle 8 ligandcomplexen vertonen een verschuiving in voorkeursoriëntatie als reactie op temperatuur in plaats van als gevolg van ligandbinding voor ten minste 1 residu rotameer in de F-helix nabij de ligandbindingsplaats. Ringer plots voor geselecteerde residuen, met rotameer verschillen bij RT (rood) versus cryo (blauw) aangegeven met pijlen. Krediet:DOI:10.1039/D1SC02751D
Ongeveer 95% van alle kristalstructuren die voor verschillende eiwitten zijn verkregen en in openbare databases zijn gedeponeerd, worden vastgelegd met behulp van cryogene technologie. Deze technologie vereist bevroren omstandigheden. Wetenschappers van het St. Jude Children's Research Hospital vergeleken cryogene structuren met die waargenomen bij kamertemperatuur. De bevindingen, vandaag gepubliceerd in Chemische Wetenschappen , geven aan dat bevriezing fouten kan introduceren, ervoor zorgen dat bepaalde conformaties (vormen) worden gemist en leiden tot onnauwkeurigheden in rekenmodellen.
Eiwitstructuren zijn essentieel voor het ontwikkelingsproces van geneesmiddelen omdat ze een kaart bieden voor hoe gerichte geneesmiddelen moeten worden ontworpen.
"We moeten heroverwegen hoe we verzamelen, structurele informatie analyseren en gebruiken wanneer we op zoek gaan naar bioactieve moleculen, " zei corresponderende auteur Marcus Fischer, doctoraat, St. Jude Afdeling Chemische Biologie en Therapeutica. "Je kunt temperatuur zien als een experimentele knop waaraan we kunnen draaien om verborgen eiwitconformaties te onderzoeken."
Temperatuur maakt het verschil
De onderzoekers hebben aangetoond dat bevriezing de conformaties verstoort die eiwitten aannemen, vaak fouten in structuren introduceren. Het team ontdekte ook dat sommige conformaties die optreden bij kamertemperatuur kunnen worden gemist als alleen wordt gekeken naar de resultaten van cryogene technieken.
De onderzoekers voerden een systematische evaluatie uit van cryogene structuren, beginnend met de T4-lysozym L99A-holte. Dit eiwit wordt in de structurele biologie beschouwd als een "werkpaard" voor het begrijpen van eiwitstabiliteit, stijfheid en ligand-bindende thermodynamica. De verschuiving naar kamertemperatuur bracht nieuwe structurele veranderingen aan het licht die decennialang zijn gemist.
Het team testte vier extra klassen eiwitten. De resultaten bleven waar, ongeacht welk type eiwit werd geëvalueerd.
"Als je in de winter naar buiten gaat en het koud hebt, je comprimeert en krimpt in jezelf, en in de zon als je het warm hebt, strek je je uit. Eiwitten doen hetzelfde, ' zei Fischer.
fouten vermijden
Computationele methoden zijn algoritmen die onderzoekers gebruiken om voorspellingen te doen of gegevens te evalueren die zijn verkregen uit hun experimenten. De resultaten geven aan dat wanneer deze methoden zijn gebaseerd op gegevens van cryogene structuren, fouten kunnen worden geïntroduceerd die toekomstige resultaten kunnen aantasten.
Cryogene technieken hebben lange tijd de voorkeur gehad omdat ze het gemakkelijker maken om de structuren te verkrijgen. Het krijgen van structuren op kamertemperatuur is vervelender. Hoewel er manieren zijn om deze problemen te verminderen, factoren zoals volledigheid van gegevens en stralingsschade zijn voor veel onderzoekers extra hindernissen bij het verkrijgen van structuren op kamertemperatuur.
Hoewel het detecteren van een verborgen eiwitvorm informatief is, waaruit bleek dat de impact van de nieuwe vorm op protocollen voor het ontdekken van geneesmiddelen nog steeds ontbrak.
"We zagen dat het eiwit een staat aannam om te interageren met liganden, en dat ontbrekende informatie kan helpen bij het verbeteren van de nauwkeurigheid van virtuele screening van geneesmiddelen en simulaties van eiwit-ligand-interacties, " zei co-eerste auteur Shanshan Bradford, doctoraat, St. Jude Afdeling Chemische Biologie en Therapeutica.
De onderzoekers onderstrepen dat wanneer alleen wordt gekeken naar cryogene structuren, er is geen manier om te zien of er fouten zijn, maar die vergelijking met structuren op kamertemperatuur kan helpen om informatie te verduidelijken en mogelijk aanvullende inzichten te onthullen die anders gemist zouden worden.
 Skies of blue:koolstofemissies recyclen tot nuttige chemicaliën en de opwarming van de aarde verminderen
Skies of blue:koolstofemissies recyclen tot nuttige chemicaliën en de opwarming van de aarde verminderen Wetenschappers ontwikkelen proces om brandstof van hogere kwaliteit te produceren uit bioafval
Wetenschappers ontwikkelen proces om brandstof van hogere kwaliteit te produceren uit bioafval Synthese van middelgrote ringstructuren
Synthese van middelgrote ringstructuren Een moleculaire motor gebruiken om de voorkeur van anionbindende katalysatoren te veranderen
Een moleculaire motor gebruiken om de voorkeur van anionbindende katalysatoren te veranderen Is uw machine learning-trainingsset bevooroordeeld? Hoe nieuwe medicijnen te ontwikkelen op basis van samengevoegde datasets
Is uw machine learning-trainingsset bevooroordeeld? Hoe nieuwe medicijnen te ontwikkelen op basis van samengevoegde datasets
 Ruimtegebaseerd systeem kan seismische monitoring bieden voor grote aardbevingen en tsunami's
Ruimtegebaseerd systeem kan seismische monitoring bieden voor grote aardbevingen en tsunami's Evacuaties van vulkaan Bali zwellen op tot meer dan 57, 000
Evacuaties van vulkaan Bali zwellen op tot meer dan 57, 000 De effecten van een cycloon
De effecten van een cycloon Duizenden vluchten terwijl een nieuwe tyfoon de Filippijnen bedreigt
Duizenden vluchten terwijl een nieuwe tyfoon de Filippijnen bedreigt Ida wil Louisiana treffen ter gelegenheid van orkaan Katrina-jubileum
Ida wil Louisiana treffen ter gelegenheid van orkaan Katrina-jubileum
Hoofdlijnen
- Wat zijn voorbeelden van homozygote dominanten?
- Voorbeelden van stoffen die gefaciliteerde diffusie gebruiken
- 10 wonderkinderen
- De verschillen tussen monosachariden en polysachariden
- De gemiddelde levensduur van skeletspiercellen
- Wanneer treedt melkzuurfermentatie op?
- Lovelorn koala gepakt na ontsnapping uit dierentuin op jacht naar partner
- 2 kiwivogels zijn zeldzaam lichtpuntje in grimmig uitstervingsrapport
- Wat is mRNA, rRNA en tRNA?
 Poreuze materialen werpen licht op milieuzuivering
Poreuze materialen werpen licht op milieuzuivering Explainer:hoe de VAE-sonde de baan van Mars bereikte
Explainer:hoe de VAE-sonde de baan van Mars bereikte Uber-glitch laat chauffeurs onbetaald en gefrustreerd achter
Uber-glitch laat chauffeurs onbetaald en gefrustreerd achter Luchtdichte maiszakken helpen honger te bestrijden tijdens de COVID-19-pandemie
Luchtdichte maiszakken helpen honger te bestrijden tijdens de COVID-19-pandemie Nieuw optisch apparaat op waterbasis zorgt voor een revolutie op het gebied van optisch onderzoek
Nieuw optisch apparaat op waterbasis zorgt voor een revolutie op het gebied van optisch onderzoek Video:Supersonische gasstralen schieten weg
Video:Supersonische gasstralen schieten weg Bioscoopabonnementsservice MoviePass wordt stopgezet
Bioscoopabonnementsservice MoviePass wordt stopgezet Ingenieurs ontwikkelen geautomatiseerde camera zonder optica die in plaats daarvan een gewoon venster als lens gebruikt
Ingenieurs ontwikkelen geautomatiseerde camera zonder optica die in plaats daarvan een gewoon venster als lens gebruikt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com