
Wetenschap
P450-peroxygenase omzetten in peroxidase via mechanismegestuurde eiwittechnologie
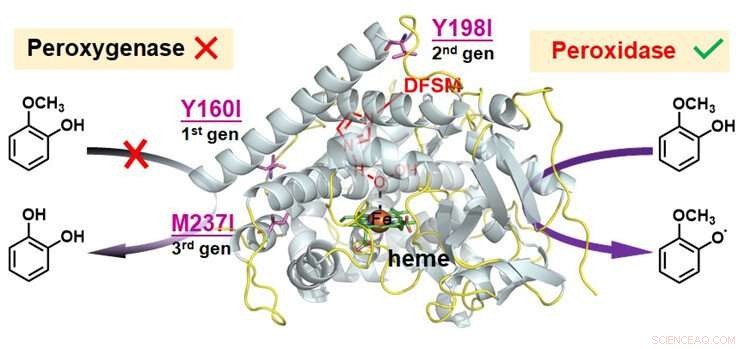
Functionele omzetting van peroxygenase naar peroxidase in DFSM-gefaciliteerde P450BM3-H 2 O 2 systeem. Krediet:Ma Nana
Enzymkatalyse is een veelbelovende groene oplossing voor de productie van geneesmiddelen, fijne chemicaliën, en biobrandstoffen. Echter, het verkennen van hun katalytische promiscuïteit om de mogelijkheden van enzymen uit te breiden en te verbeteren, blijft een uitdaging.
Een onderzoeksteam onder leiding van Dr. Cong Zhiqi van het Qingdao Institute of Bioenergy and Bioprocess Technology (QIBEBT) van de Chinese Academie van Wetenschappen (CAS) paste een strategie voor eiwittechnologie toe om redoxgevoelige residuen te muteren, waardoor het peroxygenasesysteem efficiënte peroxidase kan bereiken werkzaamheid.
De studie is gepubliceerd in ACS Katalyse op 28 juni.
In hun eerdere onderzoek de onderzoekers rapporteerden een unieke H 2 O 2 -afhankelijk cytochroom P450-systeem aangedreven door een dual-functional small molecule (DFSM), die een zeer efficiënte peroxygenase-functie vertoonden in plaats van peroxidase-activiteit. "Echter, de katalytische peroxidase-functionaliteit van P450s is nog niet volledig onderzocht, " zei dr. Cong.
Om de katalytische promiscuïteit van het door DFSM gefaciliteerde P450-H . uit te breiden 2 O 2 systeem, de onderzoekers analyseerden drie mogelijke katalytische routes in het systeem, en concludeerde dat de intrinsieke competitieve oxidatie van redox-gevoelige residuen de belangrijkste reden kan zijn om de peroxidasefunctie ervan te voorkomen.
Ze identificeerden hotspots van redoxgevoelige residuen, en vervolgens een klein aantal logisch gekozen aminozuren gebruikt om de residuen op de hotspots uit te wisselen.
Na het combineren van meerdere ronde iteratieve mutaties van redox-gevoelige residuen op verschillende locaties, de onderzoekers realiseerden de peroxidasefunctie van het door DFSM gefaciliteerde P450-H 2 O 2 systeem met efficiënte één-elektron oxidatie-activiteit naar verschillende substraten. Dit systeem bereikte de beste peroxidase-activiteit van alle tot nu toe gerapporteerde P450's, en wedijverde met de meeste natuurlijke peroxidasen.
De gezamenlijke simulatiestudie met Dr. WANG Binju van de Universiteit van Xiamen toonde de mogelijkheid aan voor de oorsprong van peroxidase-activiteit in de door DFSM gefaciliteerde P450BM3-H 2 O 2 systeem van ofwel de verwijdering van de redox-gevoelige residuen om hun competitieve oxidaties te elimineren of de wijziging van de substraatoriëntatie na eiwitengineering.
"De studie biedt nieuwe inzichten en strategieën die relevant zijn voor het uitbreiden van de katalytische promiscuïteit van P450's door de effecten van eiwitmanipulatie en exogene moleculen te combineren, " zei dr. Cong.
 Onderzoek naar schoner, efficiëntere productie van bio-energie met neutronen
Onderzoek naar schoner, efficiëntere productie van bio-energie met neutronen Laserstraalexcitatie heeft geen invloed op de nucleofiele substitutiereactie
Laserstraalexcitatie heeft geen invloed op de nucleofiele substitutiereactie Onderzoekers ontwikkelen 's werelds eerste alcoholische drank gemaakt van tofu-wei
Onderzoekers ontwikkelen 's werelds eerste alcoholische drank gemaakt van tofu-wei Wetenschappers ontwerpen een betere methode om moleculen te bouwen die medicijnen zouden kunnen zijn - in de helft van de stappen
Wetenschappers ontwerpen een betere methode om moleculen te bouwen die medicijnen zouden kunnen zijn - in de helft van de stappen Wetenschappers stemmen het systeem af om syngas te maken uit CO2
Wetenschappers stemmen het systeem af om syngas te maken uit CO2
 NASA-NOAA-satelliet ziet krachtige tropische cycloon Oma die Nieuw-Caledonië treft
NASA-NOAA-satelliet ziet krachtige tropische cycloon Oma die Nieuw-Caledonië treft Viscositeitsmetingen bieden nieuwe inzichten in de aardmantel
Viscositeitsmetingen bieden nieuwe inzichten in de aardmantel Hoe spinnen paren
Hoe spinnen paren  Milieuvriendelijke seismische technologieën zullen bijdragen aan duurzame mijnexploratie
Milieuvriendelijke seismische technologieën zullen bijdragen aan duurzame mijnexploratie De laatste wildernisgrenzen van de wereld volgen
De laatste wildernisgrenzen van de wereld volgen
Hoofdlijnen
- Verlichting aan het water verstoort de natuur in het omliggende ecosysteem drastisch
- Verrassend snelle evolutie waargenomen bij hagedissoorten
- Critici slaan VS over import van olifantentrofeeën
- De structuur van een eukaryote cel
- Zijn mannelijke Y-chromosomen korter dan X-chromosomen?
- Een eenvoudig diercelmodel maken
- Wat is apoptose?
- Wat zijn enkele voor- en nadelen van het gebruik van DNA-analyse om wetshandhaving bij misdrijven te ondersteunen?
- Voordelen en nadelen van klonen
- Proces voor het maken van plastic flessen

- Samenstellingsontwerp van legeringen met meerdere componenten door screening met hoge doorvoer

- Onderzoekers ontwikkelen nieuwe membraanloze brandstofcel

- Hoe valentie van radicalen te berekenen

- Een nieuwe benadering om de katalysatoren voor de waterstofevolutiereactie te verbeteren

 Het Penn-team bestudeert nanokristallen door ze door kleine poriën te leiden
Het Penn-team bestudeert nanokristallen door ze door kleine poriën te leiden Nieuwe multidisciplinaire benadering voor het identificeren van complexe moleculaire adsorbaten
Nieuwe multidisciplinaire benadering voor het identificeren van complexe moleculaire adsorbaten Onderzoekers presenteren een nieuwe synthetische kijk op de topografische evolutie van Tibet
Onderzoekers presenteren een nieuwe synthetische kijk op de topografische evolutie van Tibet Genetische ontdekking nog een hulpmiddel in de strijd tegen tarweplagen
Genetische ontdekking nog een hulpmiddel in de strijd tegen tarweplagen Uit nationaal onderzoek blijkt dat achtergestelde Australische volwassenen het minst mediageletterd zijn
Uit nationaal onderzoek blijkt dat achtergestelde Australische volwassenen het minst mediageletterd zijn Afbeelding:Visualisatie van de 21 augustus Totale zonsverduistering 2017
Afbeelding:Visualisatie van de 21 augustus Totale zonsverduistering 2017 Verwacht werd dat het nieuwe NC-eiland uiteindelijk zou verdwijnen, maar niet zo
Verwacht werd dat het nieuwe NC-eiland uiteindelijk zou verdwijnen, maar niet zo De voordelen van Simple Distillation
De voordelen van Simple Distillation
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Norway | Italian | Danish |

-
Wetenschap © https://nl.scienceaq.com

