
Wetenschap
Onderzoekers rapporteren omgekeerde magnesiumchemie-ontdekking
Afbeelding:Harder Group
Chemici van de Friedrich-Alexander-Universiteit Erlangen-Nürnberg hebben een doorbraak in magnesiumchemie gepubliceerd in het tijdschrift Natuur .
Magnesium (Mg) is een aardrijk metaal uit de vroege hoofdgroep met een lage elektronegativiteit dat gemakkelijk zijn valentie-elektronen verliest. In combinatie met andere elementen, het komt van nature alleen voor in zijn meest stabiele vorm als het positief geladen Mg 2+ kation. de Mg 2+ kation wordt gevonden in verschillende mineralen, maar ook in chlorofyl, het pigment dat planten groen maakt. Magnesium in de abnormale oxidatietoestand +I werd voor het eerst gedetecteerd in interstellaire wolken, maar onlangs, eerste complexen met Mg + zijn geïsoleerd.
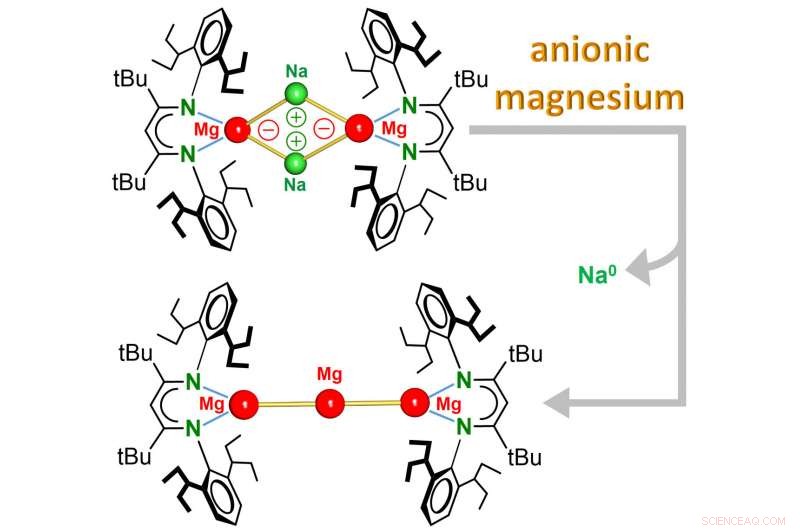
Het team rond Prof. Sjoerd Harder (Chair of Anorganic and Organometallic Chemistry) meldt nu de ontdekking van de eerste Mg 0 complexen waarin het metaal een oxidatietoestand van nul heeft en zelfs negatief geladen is. Deze complexen, die unieke magnesium-natriumbinding (Mg-Na) bevatten, totaal anders reageren dan gewone Mg 2+ verbindingen. Terwijl elektronenarm Mg 2+ kationen kunnen elektronen accepteren, het elektronenrijke anionische Mg 0 centrum reageert door elektronen af te staan.
Het complex is oplosbaar in gewone organische oplosmiddelen en is een extreem sterk reductiemiddel:Lichte verhitting leidde tot onmiddellijke reductie van de Na
+
kationen naar Na
0
, een metaal dat normaal gesproken een sterke neiging heeft om te oxideren tot Na
+
kationen. Tijdens deze thermische ontleding, er ontstaat een nieuw type complex waarin drie Mg-atomen zich als kralen in een ketting verbinden. Deze Mg
3
cluster reageert als atomaire Mg
0
en kan worden gezien als het kleinste stukje Mg-metaal, die oplosbaar is in organische oplosmiddelen. Deze nieuwe klasse van anionische Mg-complexen zet de Mg-chemie volledig op zijn kop. Verdere ongebruikelijke reactiviteit van dit oplosbare, extreem sterk, reductiemiddel kan worden verwacht.
Hoofdlijnen
- De controverse over de menselijke hersenen die nieuwe cellen maken
- Onderzoek Topic Ideeën voor Biologie
- Voordelen en nadelen van XRD en XRF
- Dodelijke vispathogeen gedetecteerd in Australië
- Voorbeelden van een recessief allel
- Hoe planten hun zaden vormen
- Biologische experimenten op de gisting van gist
- Verfijning van pesticiden om ongedierte te doden, geen bijen
- Nieuw raamwerk om microbiële interacties af te leiden
- Nieuwe tool ontwikkeld om auto-immuunziekten te diagnosticeren en te monitoren
- Video:Waar zijn eye crusties van gemaakt?

- Wat gebeurt er als u Epsom-zouten en ontsmettingsalcohol mengt?

- Deze op RNA gebaseerde techniek zou gentherapie effectiever kunnen maken

- Welke intermoleculaire krachten zijn aanwezig in water?

 Afgunst verdeelt de samenleving
Afgunst verdeelt de samenleving De Amerikaanse regering zou opnieuw satellietgegevens in rekening kunnen brengen - hier is waarom dat een grote fout zou zijn
De Amerikaanse regering zou opnieuw satellietgegevens in rekening kunnen brengen - hier is waarom dat een grote fout zou zijn Dit is waarom Galaxy Z Flip de opvouwbare telefoon is waar ik nu het meest enthousiast over ben.
Dit is waarom Galaxy Z Flip de opvouwbare telefoon is waar ik nu het meest enthousiast over ben. Onderzoekers maken slim staal, 30% sterker
Onderzoekers maken slim staal, 30% sterker T-Mobiles belofte van wijdverbreide 5G komt een stap dichterbij met nieuw lab in Washington
T-Mobiles belofte van wijdverbreide 5G komt een stap dichterbij met nieuw lab in Washington Vormveranderende gewrichten zorgen ervoor dat deze kleine robots obstakels kunnen overwinnen
Vormveranderende gewrichten zorgen ervoor dat deze kleine robots obstakels kunnen overwinnen Hoe vierkante meters te converteren naar lineaire Yards
Hoe vierkante meters te converteren naar lineaire Yards  AI helpt wetenschappers nieuwe kraters op Mars te ontdekken
AI helpt wetenschappers nieuwe kraters op Mars te ontdekken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | French |

-
Wetenschap © https://nl.scienceaq.com


