
Wetenschap
Wanneer werkzame stof en doeleiwit elkaar omarmen
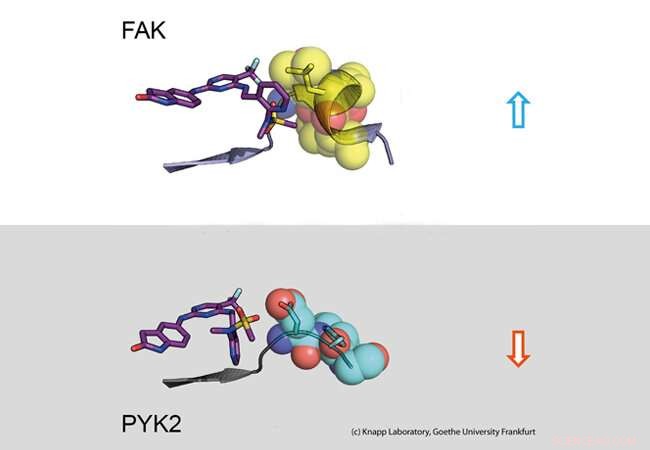
Bovenste deel:Lange verblijftijd. Een remmer (links:stickmodel) bindt aan het signaalmolecuul FAK (rechts:een deel van het FAK-eiwit afgebeeld als calottemodel met bolletjes). De structurele verandering van FAK veroorzaakt hydrofobe contacten (geel, zogenaamde DFG-motief) en een langdurig engagement. Onderste deel:Korte verblijftijd. PYK2-signaaleiwit verandert zijn structuur niet bij binding van de remmer, wat resulteert in een snelle remmerdissociatie. Krediet:Knapp Laboratorium, Goethe-universiteit Frankfurt
Veel geneesmiddelen tegen kanker blokkeren signalen in kankercellen die gedegenereerde cellen helpen zich ongecontroleerd te vermenigvuldigen en los te laten van weefsel. Bijvoorbeeld, het blokkeren van het signaaleiwit FAK, een zogenaamde kinase, zorgt ervoor dat borstkankercellen minder mobiel worden en dus minder snel uitzaaien. Het probleem is dat wanneer FAK wordt geblokkeerd door een remmer, het nauw verwante signaaleiwit PYK2 wordt veel actiever en neemt zo een deel van de taken van FAK over. Het ideaal zou daarom een remmer zijn die zowel FAK als PYK2 zo lang mogelijk op dezelfde manier remt.
Een internationaal team onder leiding van de farmaceutisch chemicus prof. Stefan Knapp van de Goethe-universiteit heeft een reeks speciaal gesynthetiseerde FAK-remmers onderzocht. Alle remmers bonden met ongeveer dezelfde snelheid aan het FAK-eiwit. Echter, ze verschilden in de duur van de binding:de meest effectieve remmer bleef het langst gebonden aan het FAK-signaleringseiwit.
Met behulp van structurele en moleculair biologische analyses en computersimulaties, het onderzoeksteam ontdekte dat binding van remmers die lange tijd in de FAK-bindingpocket blijven, een structurele verandering teweegbrengt. Dus, door binding van deze remmers, FAK verandert van vorm en vormt een specifiek, waterafstotende structuur op contactplaatsen met de remmer, vergelijkbaar met een intieme omhelzing.
Het nauw verwante eiwit PYK2, anderzijds, bleef relatief stijf, en hoewel de meest effectieve FAK-remmer ook PYK2 blokkeerde, het effect ervan was significant zwakker door het snel dissociëren van remmers van de bindingsplaats. interessant, computersimulaties waren in staat om de kinetiek van binding zeer goed te voorspellen, het verschaffen van een methode voor nauwkeurige simulatie van dissociatiesnelheden van geneesmiddelen voor toekomstige optimalisatie van kandidaat-geneesmiddelen.
Prof. Stefan Knapp legt uit, "Omdat we nu een beter begrip hebben van de moleculaire mechanismen van de interactie van krachtige remmers van deze twee kinasen, we hopen in de toekomst computersimulaties te kunnen gebruiken om de verblijftijden van remmers en kandidaat-geneesmiddelen beter te voorspellen. Tot dusver, Er is weinig aandacht besteed aan de kinetische eigenschappen van geneesmiddelbinding. Echter, deze eigenschap is nu naar voren gekomen als een belangrijke parameter voor de ontwikkeling van effectievere geneesmiddelen die zijn ontworpen om hun doeleiwitten te remmen - zoals in het geval van FAK en PYK2 - niet alleen krachtig maar ook voor een lange tijd."
 Zijdevezels verbeteren bioinkt voor 3D-geprinte kunstmatige weefsels en organen
Zijdevezels verbeteren bioinkt voor 3D-geprinte kunstmatige weefsels en organen Berekening van de verbrandingswarmte van paraffinewas
Berekening van de verbrandingswarmte van paraffinewas Hoe een oxidatie nummer te vinden
Hoe een oxidatie nummer te vinden  Licht-geactiveerd, single-ion katalysator breekt koolstofdioxide af
Licht-geactiveerd, single-ion katalysator breekt koolstofdioxide af Nieuwe efficiënte katalysator voor belangrijke stap in kunstmatige fotosynthese
Nieuwe efficiënte katalysator voor belangrijke stap in kunstmatige fotosynthese
Hoofdlijnen
- Paarse plant is in de verdediging
- Wat is een positieve controle in de microbiologie?
- Wat zijn de belangrijkste functies van Cilia & Flagella?
- Hoe levert embryologie bewijs voor evolutie?
- Stadia van meiose met een beschrijving
- Wetenschappers volgen aseksuele kleine wormen - waarvan de afstamming 18 miljoen jaar teruggaat
- De genetische handtekening van de zeeschelp lezen
- Baanbrekende ontdekking van een geurdetecterende receptorversterker
- Wanneer is lachen een medisch symptoom?
- High-tech detectie verlicht stresstesten voor beton

- Chemici brengen een kunstmatige moleculaire zelfassemblage in kaart met de complexiteit van het leven
- Realtime dampanalyse kan de training van explosievendetecterende honden verbeteren

- Ontdekking van een nieuwe structuurfamilie van oxide-ionengeleiders SrYbInO4

- Machine-learning maakt een voorheen ongeziene kijk op polymeren die nuttig zijn op biomedisch gebied mogelijk

 Wat is het verschil tussen alkalinebatterijen en niet-alkalinebatterijen?
Wat is het verschil tussen alkalinebatterijen en niet-alkalinebatterijen?  Pacifische koralen in zorgwekkende staat:onderzoekers
Pacifische koralen in zorgwekkende staat:onderzoekers Wat veroorzaakt algenbloei, en hoe kunnen we ze stoppen?
Wat veroorzaakt algenbloei, en hoe kunnen we ze stoppen? Onderzoek uitgevoerd om glaskeramische materialen te verkrijgen uit verlaten mijnafval
Onderzoek uitgevoerd om glaskeramische materialen te verkrijgen uit verlaten mijnafval Bitcoins-bedreiging voor het wereldwijde financiële systeem is waarschijnlijk ten einde
Bitcoins-bedreiging voor het wereldwijde financiële systeem is waarschijnlijk ten einde Wetenschappers en studenten publiceren blauwdrukken voor een goedkopere microscoop met één molecuul
Wetenschappers en studenten publiceren blauwdrukken voor een goedkopere microscoop met één molecuul Historische tyfoons reconstrueren uit een record van 142 jaar
Historische tyfoons reconstrueren uit een record van 142 jaar Dangerous Bugs & Spiders in Tennessee
Dangerous Bugs & Spiders in Tennessee
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

