Wetenschap
Licht-geactiveerd, single-ion katalysator breekt koolstofdioxide af
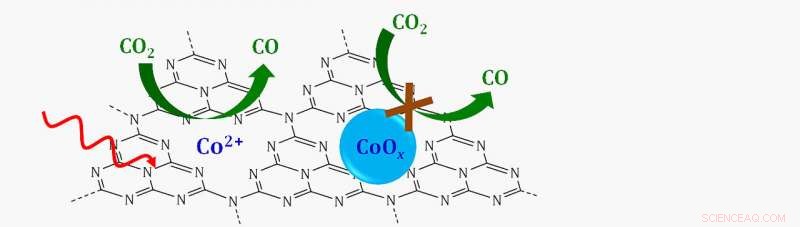
Schema van een single-site katalysator waarin enkele kobaltionen (CO 2 +) ondersteund op een grafitische koolstof-stikstoflaag (C3N4) verminderen koolstofdioxide (CO 2 ) tot koolmonoxide (CO) in aanwezigheid van zichtbaar licht (rode golvende pijl). Als kobalt met zuurstof zou worden gebonden tot kobaltoxide (CoOx), de reactie zou niet doorgaan. Krediet:Brookhaven National Laboratory
Een team van wetenschappers heeft een enkele site ontdekt, door zichtbaar licht geactiveerde katalysator die koolstofdioxide (CO 2 ) in "bouwsteen"-moleculen die kunnen worden gebruikt voor het maken van nuttige chemicaliën. De ontdekking opent de mogelijkheid om zonlicht te gebruiken om een broeikasgas om te zetten in koolwaterstofbrandstoffen.
De wetenschappers gebruikten de National Synchrotron Light Source II, een gebruikersfaciliteit van het Amerikaanse Department of Energy (DOE) Office of Science in Brookhaven National Laboratory, om details van de efficiënte reactie te ontdekken, die een enkel kobalt-ion gebruikte om de energiebarrière voor het afbreken van CO . te verlagen 2 . Het team beschrijft deze single-site katalysator in een paper dat zojuist is gepubliceerd in de Tijdschrift van de American Chemical Society .
CO . omzetten 2 in eenvoudiger onderdelen - koolmonoxide (CO) en zuurstof - heeft waardevolle toepassingen in de echte wereld. "Door CO . te breken 2 , we kunnen twee vliegen in één klap slaan:CO2 uit de atmosfeer halen en bouwstenen maken om brandstof te maken, " zei Anatoly Frenkel, een chemicus met een gezamenlijke aanstelling bij Brookhaven Lab en Stony Brook University. Frenkel leidde de inspanning om de activiteit van de katalysator te begrijpen, die werd gemaakt door Gonghu Li, een fysisch chemicus aan de Universiteit van New Hampshire.
"We hebben nu bewijs dat we een single-site katalysator hebben gemaakt. Geen eerder werk heeft melding gemaakt van CO van zonne-energie 2 reductie met behulp van een enkel ion, ' zei Frenkel.
De bindingen verbreken die CO . bevatten 2 samen kost veel energie en veel tijd. Dus, Li wilde een katalysator ontwikkelen om de energiebarrière te verlagen en het proces te versnellen.
"De vraag is, tussen verschillende mogelijke katalysatoren, die efficiënt en praktisch te implementeren zijn in de industrie?", aldus Frenkel.
Een belangrijk ingrediënt dat nodig is om de bindingen van CO . te verbreken 2 is een aanbod van elektronen. Deze elektronen kunnen worden gegenereerd wanneer een materiaal dat bekend staat als een halfgeleider wordt geactiveerd door energie in de vorm van licht. Het licht "schopt" elektronen naar buiten, bij wijze van spreken, waardoor ze beschikbaar zijn voor de katalysator voor chemische reacties. Zonlicht zou een natuurlijke bron van dergelijk licht kunnen zijn. Maar veel halfgeleiders kunnen alleen worden geactiveerd door ultraviolet licht, die minder dan vijf procent van het zonnespectrum uitmaakt.
"De uitdaging is om een ander halfgeleidermateriaal te vinden waar de energie van natuurlijk zonlicht een perfecte match zal zijn om de elektronen eruit te schoppen, ' zei Frenkel.
De wetenschappers hadden ook nodig dat de halfgeleider werd gebonden aan een katalysator gemaakt van materialen die overvloedig in de natuur te vinden waren, in plaats van zeldzaam, dure metalen zoals platina. En ze wilden dat de katalysator selectief genoeg zou zijn om alleen de reactie aan te sturen die CO . omzet 2 naar CO.
"We willen niet dat de elektronen worden gebruikt voor andere reacties dan het verminderen van CO 2 , ' zei Frenkel.
Kobaltionen gebonden aan grafietkoolstofnitride (C3N4), een halfgeleider gemaakt van koolstof, stikstof, en waterstofatomen, alle vakjes voor deze vereisten heeft aangevinkt.
"Er is aanzienlijke interesse geweest in het gebruik van C3N4 als een metaalvrije halfgeleider om zichtbaar licht te oogsten en chemische reacties aan te sturen, " zei Li. "Elektronen gegenereerd door C3N4 onder bestraling met licht hebben een energie die hoog genoeg is om CO . te verminderen 2 . Dergelijke elektronen hebben vaak niet een lange levensduur om ze naar het halfgeleideroppervlak te laten reizen voor gebruik in chemische reacties. In onze studie, we hebben een gemeenschappelijke en effectieve strategie aangenomen om voldoende energetische elektronen voor de katalysator op te bouwen door een opofferende elektronendonor te gebruiken. Door deze strategie konden we ons concentreren op de katalyse voor CO 2 vermindering. uiteindelijk, we willen watermoleculen gebruiken als elektronendonor voor onze katalyse, " hij voegde toe.
Peipei Huang, een postdoctoraal onderzoeker in Li's lab, maakte de katalysator door eenvoudig kobaltionen af te zetten op een C3N4-materiaal gemaakt van in de handel verkrijgbaar ureum. Het team onderzocht vervolgens de gesynthetiseerde katalysator uitgebreid met behulp van verschillende technieken in samenwerking met Christine Caputo van de Universiteit van New Hampshire en Ronald Grimm van het Worcester Polytechnic Institute.
De katalysator werkte in CO 2 reductie onder bestraling met zichtbaar licht.
"Deze katalysator deed wat hij moest doen:CO . afbreken 2 en maak CO met een zeer goede selectiviteit in zichtbaar licht, Frenkel zei. "Maar het volgende doel was om te zien waarom het werkte. Als je begrijpt waarom het werkt, kun je op basis van die principes nieuwe en betere materialen maken."
Dus Frenkel en Li brainstormden over experimenten die de structuur van de katalysator nauwkeurig zouden laten zien. Structurele studies zouden de wetenschappers informatie geven over het aantal kobaltatomen, hun locatie ten opzichte van de koolstof- en stikstofatomen, en andere kenmerken die de wetenschappers mogelijk zouden kunnen aanpassen om te proberen de katalysator verder te verbeteren.
Ze wendden zich tot de Quick X-ray Absorption and Scattering (QAS) -bundellijn bij NSLS-II om röntgenabsorptiespectroscopie te gebruiken. Met hulp van hoofdbundellijnwetenschapper Steven Ehrlich, Frenkel's student Jiahao Huang nam de gegevens en analyseerde de spectra.
Bij deze techniek, de röntgenstralen van NSLS-II worden geabsorbeerd door atomen in het monster, die vervolgens elektronengolven uitstoten. De spectra laten zien hoe deze elektronengolven interageren met omringende atomen, vergelijkbaar met de manier waarop rimpelingen op het oppervlak van een meer worden verstoord wanneer ze rotsen tegenkomen.
"Om röntgenabsorptiespectroscopie (XAS) te kunnen doen, we moeten de energie van de röntgenstraal die het monster raakt afstemmen en scannen, " zei Ehrlich. "Elk element kan röntgenstralen absorberen met verschillende energieën, absorptieranden genoemd. Bij de nieuwe QAS-bundellijn kunnen we de energie van de röntgenstralen scannen over de absorptierandenergie van verschillende elementen, zoals kobalt in dit geval. Vervolgens meten we voor elke waarde van de röntgenenergie het aantal fotonen dat door het monster wordt geabsorbeerd."
In aanvulling, Frenkel legde uit, "elk type atoom produceert een ander soort elektronische rimpel, wanneer opgewonden door röntgenstralen, of wanneer geraakt door andere rimpelingen, dus het röntgenabsorptiespectrum vertelt je wat de omringende atomen zijn en ook hoe ver uit elkaar en hoeveel er zijn."
Uit de analyse bleek dat de katalysator die CO . afbreekt 2 was gemaakt van enkele kobalt-ionen, aan alle kanten omgeven door stikstofatomen.
"Er waren geen kobalt-kobaltparen. Dus, dit was het bewijs dat het in feite enkele kobaltatomen waren die op het oppervlak waren verspreid, ' zei Frenkel.
"Deze gegevens beperken ook de mogelijke structurele regelingen, die informatie biedt voor theoretici om de reacties volledig te evalueren en te begrijpen, ’ voegde Frenkel eraan toe.
Hoewel de wetenschap die in het artikel wordt geschetst nog niet in de praktijk wordt gebruikt, er zijn volop mogelijkheden voor toepassingen, zei Frenkel. In de toekomst, dergelijke single-site katalysatoren kunnen worden gebruikt in grootschalige gebieden met veel zonlicht om overtollig CO . af te breken 2 in de atmosfeer, vergelijkbaar met de manier waarop planten CO . afbreken 2 en hergebruik de bouwstenen om suikers te bouwen tijdens het fotosyntheseproces. Maar in plaats van suikers te maken, wetenschappers kunnen de CO-bouwstenen gebruiken om synthetische brandstoffen of andere nuttige chemicaliën te genereren.
 Schakel de klimatologische factoren in die de vegetatiedynamiek op het Tibetaanse plateau regelen
Schakel de klimatologische factoren in die de vegetatiedynamiek op het Tibetaanse plateau regelen Gebruik voor zonnebloemzaadschelpen
Gebruik voor zonnebloemzaadschelpen  Amerikaanse versnellingen voor stijgend dodental bij bosbranden westkust
Amerikaanse versnellingen voor stijgend dodental bij bosbranden westkust Klimaatrapport moet doodsklok zijn voor fossiele brandstoffen:VN-chef
Klimaatrapport moet doodsklok zijn voor fossiele brandstoffen:VN-chef Nieuwe aanpak van supergladde verpakkingen is bedoeld om voedselverspilling te verminderen
Nieuwe aanpak van supergladde verpakkingen is bedoeld om voedselverspilling te verminderen
Hoofdlijnen
- Wat zijn Agar Slants?
- Wat is een tetrad in de microbiologie?
- Terugkeer van de inheemse wilde kalkoen - duurzame oogstdoelen stellen wanneer de informatie beperkt is
- Synthetische seks in gist belooft veiligere medicijnen voor mensen
- De chemische samenstelling van uitgeademde lucht uit menselijke longen
- Science Fair-projecten met nagellak
- Elandenpopulatie in Vermont worstelt ondanks bezuiniging op jacht
- Tropische diversiteit wortelt in relaties tussen schimmels en zaden
- Tasmaanse tijger gedoemd lang voordat er mensen kwamen
 Softbank verlaagt investering in WeWork tot $ 2 miljard
Softbank verlaagt investering in WeWork tot $ 2 miljard NASA meet tropische cycloon Noras overstromingsregens in Queensland
NASA meet tropische cycloon Noras overstromingsregens in Queensland Starbucks sluit winkels in de VS wegens raciale vooroordelen
Starbucks sluit winkels in de VS wegens raciale vooroordelen Waar vindt plantenademhaling plaats?
Waar vindt plantenademhaling plaats?  Insecten eten is goed voor jou en de planeet, onderzoekers staan erop:
Insecten eten is goed voor jou en de planeet, onderzoekers staan erop: UTA regionale beoordeling toont segregatie, uitdagingen
UTA regionale beoordeling toont segregatie, uitdagingen Nieuw onderzoek toont de beperkingen van coördinatie in de chemie aan
Nieuw onderzoek toont de beperkingen van coördinatie in de chemie aan Pas op voor de fax:sommige hackers richten zich op oude gadgets
Pas op voor de fax:sommige hackers richten zich op oude gadgets
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com