
Wetenschap
Eiwitkameleon kleurt langetermijngeheugen
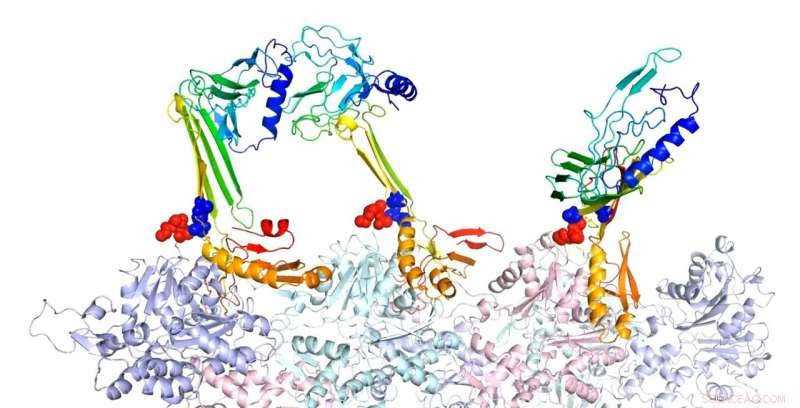
Onderzoekers van de Rice University hebben de bindingsstructuren van actine en geassocieerde eiwitten gemodelleerd die volgens hen verantwoordelijk zijn voor de vorming van langetermijngeheugen. Hier, de bèta-haarspeldvorm van de ritssluitingsequentie is een potentiële kern voor de vorming van intramoleculaire bètabladen. In de voorspelde complexe structuur van F-actine en drie hierboven getoonde PRD + ABD-constructen, de drie PDB+ABD-constructies worden weergegeven in regenboogkleur, van blauw naar rood, van N-terminal naar C-terminal. De oppervlakken van de eerste 4 negatieve residuen van actinemonomeren zijn rood gekleurd en de oppervlakken van de twee positieve uiteinden van de ritssequentie zijn blauw gekleurd. Krediet:Centrum voor Theoretische Biologische Fysica/Rice University
Een kameleonachtig eiwit in neuronen kan van gedachten veranderen, en in het proces veranderen onze hersenen.
Wetenschappers van Rice University en het University of Texas Health Science Center in Houston (UTHealth) hebben nieuwe aanwijzingen in het eiwit CPEB3 ontdekt als onderdeel van hun hardnekkige zoektocht naar het mechanisme dat mensen in staat stelt langetermijnherinneringen te hebben.
De studie van Rice theoretisch biofysicus Peter Wolynes en Neal Waxham, een neurobioloog aan de McGovern Medical School van UTHealth, geeft inzicht in een positieve feedbacklus tussen het vormen van de actine-ruggengraat die dendritische stekels hun vorm en flexibiliteit geven en de actine-bindende domeinen in CPEB3, een functioneel prion dat RNA bindt dat ook langlevende aggregaten vormt die inderdaad de dingen kunnen opslaan waaruit herinneringen zijn gemaakt.
Eiwitvouwmodellen door Wolynes en zijn groep bij Rice's Center for Theoretical Biological Physics (CTBP) en experimenten bij UTHealth leverden voorheen onbekende structurele details op voor CPEB3 en hoe het bindt aan actine, zoals gerapporteerd in de Proceedings van de National Academy of Sciences papier.
In het proces, ze onderzochten ook de sleutelrol die wordt gespeeld door een eiwit dat bekend staat als SUMO, een regulator die zich hecht aan en losmaakt van andere eiwitten in cellen om hun functies te wijzigen. De onderzoekers vermoeden dat het helpt te reguleren wanneer en hoe de kameleonachtige uiteinden van CPEB3 (de N-terminus en C-terminus) binden aan SUMO of de flexibele, filamenteuze actine (f-actine) stekels in dendritische spikes.
CPEB3-eiwitten zijn oplosbaar wanneer ze aan SUMO zijn bevestigd, die ook hun actine-bindingsplaatsen begraaft. Maar tijdens synaptische activiteit, ze kunnen worden "gedeSUMOyleerd" en beschikbaar komen om te binden met de hydrofobe bindingsholtes langs f-actinefilamenten.
De modellen laten zien dat wanneer aangetrokken tot actine, CPEB3 gaat over van een opgerolde spiraal van helices naar een bèta-bladstructuur die "zipt" in een haarspeldconfiguratie waardoor het kan aggregeren met andere CPEB3-eiwitten.
Bij aggregatie, CPEB3 lijkt zijn doelboodschapper-RNA's te vertalen, waaronder actine-mRNA dat de synaptische verbindingen versterkt die essentieel zijn voor het geheugen, het voltooien van de positieve lus.
"Dit is een ambitieuzer project dan de actine-CaM-kinase-studie, waar we ook een enorm actinesysteem hebben gesimuleerd met een echt enorm eiwit, " zei Wolynes. In die studie, een jaar geleden gepubliceerd, CTBP-onderzoekers hebben gemodelleerd hoe een centraal eiwit (CaMKII) parallelle actinefilamenten bij elkaar houdt, een toestand die kon worden gevisualiseerd in een elektronenmicroscoop door Waxham's lab.
Nu definiëren de onderzoekers de structurele details waardoor CPEB3 kan binden aan actine of SUMO, maar niet allebei. "Een van de belangrijkste aspecten van dit artikel is om die twee heel verschillende delen van het verhaal met elkaar te verzoenen, " zei hij. "We denken dat de CPEB-terminals kameleonachtig zijn omdat ze het molecuul laten kiezen of het een interactie aangaat met de SUMO of met de actine.
"We zijn nog niet aan het einde van het verhaal, " zei Wolynes. "Maar de laatste resultaten stellen ons in staat om meer te zeggen over het mechanisme."
 Onderzoeker ontwikkelt een nieuwe, darm-gezonde pindakaas
Onderzoeker ontwikkelt een nieuwe, darm-gezonde pindakaas Succesvolle synthese van perovskiet zichtbaar lichtabsorberend halfgeleidermateriaal
Succesvolle synthese van perovskiet zichtbaar lichtabsorberend halfgeleidermateriaal Nieuwe rekentechniek lost gecomprimeerde röntgengegevens op
Nieuwe rekentechniek lost gecomprimeerde röntgengegevens op Onderzoekers rapporteren efficiënte platformtechnologie voor de productie van cefalosporine-antibiotica
Onderzoekers rapporteren efficiënte platformtechnologie voor de productie van cefalosporine-antibiotica Chemische octopus vangt stiekeme aanwijzingen voor kanker, sporen van glycoproteïnen
Chemische octopus vangt stiekeme aanwijzingen voor kanker, sporen van glycoproteïnen
Hoofdlijnen
- Indonesië's selfiesnagende aap uitgeroepen tot Persoon van het Jaar
- Wat is Feedback-inhibitie en waarom is het belangrijk bij het reguleren van de enzymactiviteit?
- Waarom haten sommige mensen het geluid van kauwen? Wetenschappers hebben misschien het antwoord
- Afbraak in het Noordpoolgebied
- Eenmaal uitgestorven verklaard, Lord Howe Island wandelende takken leven echt
- Continentale controles nodig om de strijd tegen boomziekten te handhaven
- Cladistics: Definitie, methode en voorbeelden
- Onderscheid Rigor Mortis van een Cadaveric Spasm
- Dino-dodende asteroïde versnelde evolutie van vogels
- Samengesteld metaalschuim presteert beter dan aluminium voor gebruik in vliegtuigvleugels

- Onderzoekers klokken DNA's hersteltijd na chemotherapie

- Chirurgisch materiaal op basis van eierschalen voor schedelverwondingen
- Hoe ontstaan kationen?

- Hoe broeikasgas verminderen? Tips van een methaan-etende microbe

 Houtproducten verminderen minder dan 1% van de wereldwijde CO2-uitstoot
Houtproducten verminderen minder dan 1% van de wereldwijde CO2-uitstoot Europa op zijn hoede terwijl Facebook de uitdaging van cryptocurrency aangaat
Europa op zijn hoede terwijl Facebook de uitdaging van cryptocurrency aangaat Snel 3D-printen met zichtbaar licht
Snel 3D-printen met zichtbaar licht Cybercriminelen:het wordt een stuk verwarrender voor u
Cybercriminelen:het wordt een stuk verwarrender voor u Was het leven op de vroege aarde paars?
Was het leven op de vroege aarde paars? Ultradunne organische zonnecel is efficiënt en duurzaam
Ultradunne organische zonnecel is efficiënt en duurzaam DIY:wetenschappers brengen een how-to uit voor het bouwen van een smartphonemicroscoop
DIY:wetenschappers brengen een how-to uit voor het bouwen van een smartphonemicroscoop Nieuw onderzoek naar low-noise en high-performance transistors kan innovaties op het gebied van elektronica opleveren, voelen
Nieuw onderzoek naar low-noise en high-performance transistors kan innovaties op het gebied van elektronica opleveren, voelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

