
Wetenschap
Nieuw ontwerp van bioactieve peptide-nanovezels die zowel de temperatuuromkeerbaarheid als de stijfheid onder controle houden

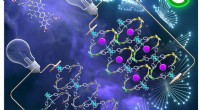
Temperatuurrespons van het peptide. Het vormt vast (gel) bij 20 graden Celsius en vloeibaar (sol) bij 80 graden Celsius aangegeven door witte haakjes, en deze functie is omkeerbaar. Krediet:Takahiro Muraoka, TUAT
Een samenwerking, voornamelijk geleid door wetenschappers van de Tokyo University of Agriculture and Technology (TUAT) in Japan, heeft een nieuwe methode van moleculair ontwerp ontwikkeld om zowel de temperatuuromkeerbaarheid als de stijfheid van nanovezels die gelvormende peptiden zijn, te beheersen. De peptide-nanovezel-hydrogel kan worden gebruikt als biomedisch materiaal. Deze methode zal het mogelijk maken om de peptide nanovezels meer biomedisch toepasbaar te maken.
De onderzoekers publiceerden hun resultaten op 8 juli in Chemie - een Europees tijdschrift , die werd gemarkeerd op de vooromslag en het omslagprofiel.
In het algemeen, sommige peptiden vormen nanovezelhydrogels. Deze peptiden zijn korte ketens van natuurlijke aminozuren die in alle levende organismen worden aangetroffen. Omdat deze bio-vriendelijk zijn, ze zijn veel gebruikt in de geneeskunde, zoals materialen voor weefselherstel, regeneratieve medische materialen, extracellulaire matrices, celcultuur materialen, en medicijncontainers.
"Voor sommige medische toepassingen van nanovezelpeptiden, we moeten een techniek ontwikkelen om zowel de stijfheid (mechanische sterkte) als de temperatuurrespons tussen gel (vast) en sol (vloeibaar) te regelen, " zei Takahiro Muraoka, doctoraat, corresponderende auteur op het papier en universitair hoofddocent bij de afdeling Toegepaste Chemie, Graduate School of Engineering bij TUAT. "Het is, echter, moeilijk om beide functies tegelijkertijd te verbeteren. Bijvoorbeeld, bij het verhogen van de stijfheid van een peptide-nanovezel door vervanging van een eenvoudig aminozuur alanine door een meer hydrofoob aminozuur fenylalanine, het is bekend dat de temperatuurrespons vaak verloren gaat."
In hun experimenten, ze ontdekten dat een aminozuurvervanging waarvan werd gedacht dat het een zachtere gel zou maken, onverwacht een hardere gel vormde. Ze gebruikten 5 sets van verschillende peptiden met 16 aminozuren. interessant, een bepaald peptide verloor geen temperatuurrespons. Het peptide (concentratie bij 1% in oplossing) vormde een gel (vast) bij 20°C (68°F) en bij verhoging van de temperatuur tot 80°C (178°F) werd de gel zacht (vloeibaar). Bij het verlagen van de temperatuur van 80°C naar 20°C, de vaste gel werd opnieuw gevormd. "Deze omkeerbare temperatuurfunctie is toepasbaar voor medicijnafgifte door lokale injectie, ' zei Muraoka.
Ze vervingen alanine in het midden van het peptide door glycine, het eenvoudigste aminozuur. De glycine-vervanging maakt de gel meestal zachter. Ze gebruikten reguliere analytische instrumenten zoals CD, IR, en TEM-microscopie om precies te begrijpen hoe de gel werd gevormd. Ze gebruikten ook een computationele benadering, moleculaire dynamica-simulatie genoemd. "Op basis van onze resultaten, we zijn nu in staat om peptiden beter te ontwerpen door computersimulatie, ' zei Muraoka.
Verder, de peptide-nanovezel was celkleefstof, dat geschikt is als biomateriaal voor celkweek en weefselregeneratie. "Dit onderzoek zal nieuwe wegen openen voor het ontwerpen van peptide-nanovezels die meer biomedisch toepasbaar zijn, ' voegde Muraoka toe.
 De geheimen van chemische binding ontrafelen met machine learning
De geheimen van chemische binding ontrafelen met machine learning Hoe wetenschappelijke experimenten met zout uit te voeren
Hoe wetenschappelijke experimenten met zout uit te voeren  Knijp er gewoon in - onderzoekers ontdekken wanneer ruimtes krap zijn, de natuur versoepelt haar wetten
Knijp er gewoon in - onderzoekers ontdekken wanneer ruimtes krap zijn, de natuur versoepelt haar wetten Wat bepaalt de hoeveelheid chemische energie die een stof heeft?
Wat bepaalt de hoeveelheid chemische energie die een stof heeft?  Lab op een chip kan gezondheid monitoren, ziektekiemen en verontreinigende stoffen
Lab op een chip kan gezondheid monitoren, ziektekiemen en verontreinigende stoffen
 Winst maximaliseren door pluimveestrooisel als meststof te gebruiken
Winst maximaliseren door pluimveestrooisel als meststof te gebruiken Bosbranden breken uit in Zuid-Florida
Bosbranden breken uit in Zuid-Florida Ingenieurs onderzoeken stedelijke koelstrategieën met behulp van reflecterende oppervlakken
Ingenieurs onderzoeken stedelijke koelstrategieën met behulp van reflecterende oppervlakken Onderzoekers onderzoeken de effecten van herhaalde droogte op verschillende soorten bossen
Onderzoekers onderzoeken de effecten van herhaalde droogte op verschillende soorten bossen Model voorspelt wanneer rivieren die breuken kruisen van koers veranderen
Model voorspelt wanneer rivieren die breuken kruisen van koers veranderen
Hoofdlijnen
- Wetenschappers ontwerpen bacteriën om sonarsignalen te reflecteren voor ultrasone beeldvorming
- Waarom stak de olifant de weg over? In Maleisië, ze proberen het antwoord te vinden
- Waarom het de menselijke natuur is om onze instincten te negeren
- Typen cellijnen
- Het korstmos dat zijn voortplantingsstrategie verandert afhankelijk van het klimaat
- Otzi the Iceman at een vetrijke laatste maaltijd
- Puget Sound-walvissen krijgen gratis een pauze van watersporters om walvissen te spotten
- Nieuwe slimme sensor om boeren te helpen kreupelheid bij schapen te herkennen
- Hoe de gecorrigeerde WBC-telling te berekenen
- Duidelijkheid nodig in classificatiesystemen voor bewerkte voedingsmiddelen

- Buigbaar ijs maken door monokristallijne microvezels te kweken

- Een zelfherstellende structurele kleurhydrogel geïnspireerd door de natuur

- Knijp de schok eruit:wat verschillende fasen van piëzo-elektrische materialen ons vertellen?

- Nieuwe MOF is potentiële next-gen halfgeleider
 Ultralumineuze röntgenpulsar M51 ULX-7 geïnspecteerd door onderzoekers
Ultralumineuze röntgenpulsar M51 ULX-7 geïnspecteerd door onderzoekers Kwarts recyclen uit mijnafval
Kwarts recyclen uit mijnafval Een uitgebalanceerd filter voor het nemen van optimale beslissingen
Een uitgebalanceerd filter voor het nemen van optimale beslissingen NASA Maps Typhoon Nock-tientallen levenslange regenval als de storm afzwakt
NASA Maps Typhoon Nock-tientallen levenslange regenval als de storm afzwakt Alleen toespelingen kunnen complottheorieën voeden, uit onderzoek blijkt
Alleen toespelingen kunnen complottheorieën voeden, uit onderzoek blijkt Bijna de helft van de werelderfgoedlocaties zou tegen 2100 . hun gletsjers kunnen verliezen
Bijna de helft van de werelderfgoedlocaties zou tegen 2100 . hun gletsjers kunnen verliezen Een nieuwe manier om vlamvertrager in een lithium-ionbatterij te plaatsen
Een nieuwe manier om vlamvertrager in een lithium-ionbatterij te plaatsen Het metrische systeem voor Kids
Het metrische systeem voor Kids
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

