
Wetenschap
Antacida helpt tuberculosebacteriën te overleven
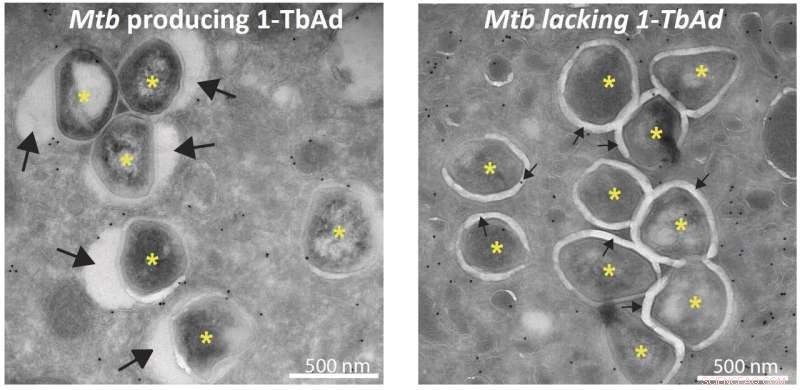
Elektronenmicroscopiefoto's die de bacteriën (*) tonen die 1-TbAd produceren, zijn omgeven door een gezwollen fagosoom (grote pijlen, linkerfoto) en bacteriën die geen 1-TbAd produceren, zijn omgeven door strakke fagosomen (kleine pijlen, rechter foto). Krediet:Buter et al. / Natuur Chemische Biologie
in 2017, ongeveer 10 miljoen mensen leden aan tuberculose en 1,6 miljoen stierven aan de ziekte. Een van de redenen waarom infectie met Mycobacterium tuberculosis zo moeilijk te behandelen is, is omdat de bacteriën zich in immuuncellen kunnen verbergen. Rijksuniversiteit Groningen wetenschappers, samen met een team van de afdeling Reumatologie, immunologie en allergie onder leiding van professor D. Branch Moody aan de Harvard Medical School en verschillende andere collega's, hebben nu een sleutelmechanisme in de bacteriën ontdekt dat voorkomt dat de immuuncellen ze doden:de bacteriën produceren een uniek type antacidum dat de immuuncellen indigestie geeft. De resultaten zijn gepubliceerd in Natuur Chemische Biologie op 19 augustus 2019.
Binnendringende bacteriën worden opgeslokt door immuuncellen die macrofagen worden genoemd. Ze kapselen de indringers in in een fagosoom, een blaasje dat vervolgens versmelt met een ander blaasje vol enzymen, het lysosoom. Na deze fusie, de enzymen breken de bacteriën af. Maar niet in het geval van Mycobacterium tuberculosis:"Ze kunnen jarenlang overleven in een macrofaag, waar antibiotica ze nauwelijks kunnen bereiken, " legt RUG-chemicus Jeffrey Buter uit, eerste auteur van het artikel. Hij werkt al jaren aan tuberculose in Groningen onder begeleiding van prof.dr. Adri Minnaard, evenals aan de Harvard Medical School, onder supervisie van professor David Branch Moody. Beide begeleiders zijn gezamenlijke hoofdauteurs van het nieuwe artikel.
virulentie
In een eerdere studie gepubliceerd in 2014, het team identificeerde lipiden die aanwezig zijn in M. tuberculosis maar niet in M. bovis, een bacterie die veel minder virulent is. De lipiden die specifiek zijn voor M. tuberculosis zouden een rol kunnen spelen bij virulentie. Inderdaad, een belangrijke kandidaat werd gevonden en geïdentificeerd als 1-tuberculosinyladenosine (1-TbAd), een adenosine gemodificeerd door de aanhechting van een lipide op de 1-positie. "Zo'n wijziging is uiterst zeldzaam in de natuur, " zegt Buter, "maar M. tuberculosis produceert en geeft een relatief grote hoeveelheid van deze verbinding af."
Er werden twee enzymen geïdentificeerd die cruciaal zijn voor de productie van 1-TbAd, maar het mechanisme waarmee dit molecuul de tuberculosebacterie hielp overleven, bleef een mysterie. "Vervolgens, vonden we onderzoek uitgevoerd door een andere groep in 2004, waarin werd aangetoond dat de fusie van het fagosoom en het lysosoom door deze enzymen werd geblokkeerd. Omdat het fagosoom zuur moet zijn voor fusie, dit leidde ons tot de hypothese dat 1-TbAd een rol speelde bij het voorkomen van verzuring van het fagosoom."
maagzuurremmer
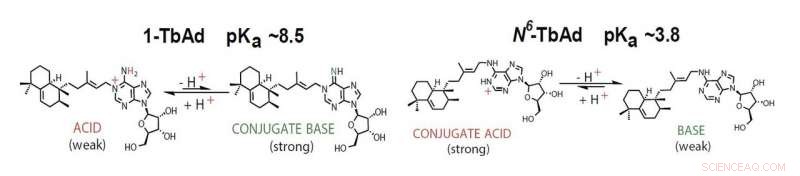
1-TbAd werkt als een zuur of geconjugeerde base, afhankelijk van de zuurgraad van de omgeving. Krediet:Buter et al / Natuur Chemische Biologie
'1-TbAd is een zwak zuur en in evenwicht met zijn basische tegenhanger, " vervolgt Buter. "In de zure omgeving van het fagosoom, deze base zal de zuurgraad verminderen." Deze bevinding suggereerde dat het molecuul werkt als een antacidum en voorkomt dat het fagosoom de zuurgraad bereikt die nodig is om met het lysosoom te fuseren.
De groep voerde een reeks experimenten uit om de mogelijkheid uit te sluiten dat de adenosineverbinding via een receptor werkte. De bevindingen bevestigden dat 1-TbAd inderdaad werkt door de zuurgraad direct te verlagen. Buter synthetiseerde verschillende varianten van het molecuul om te bepalen welke delen van het molecuul essentieel waren voor zijn functie. "Het lipidedeel is nodig om de membranen te passeren en in de fagosomen en lysosomen te komen, ' zegt Boter.
Malaria
Microscopiestudies uitgevoerd in het laboratorium van Nicole van der Wel in het Amsterdam UMC laten zien dat blootstelling van macrofagen aan 1-TbAd ervoor zorgt dat hun lysosomen tot vijf keer hun normale grootte opzwellen. Testen met macrofagen geïnfecteerd met M. tuberculosis laten zien dat de fagosomen alleen significant zwellen in aanwezigheid van het enzym Rv3378c dat nodig is om 1-TbAd te produceren. "Er zijn verschillende mechanismen die voorkomen dat de macrofagen M. tuberculosis doden, maar we ontdekten wat een sleutelmechanisme lijkt te zijn voor bacteriële overleving."
interessant, het mechanisme waarmee 1-TbAd werkt is hetzelfde als hoe chloroquine de malariaparasiet doodt. "Dit medicijn blokkeert de werking van de lysosomen van de parasiet." Het suggereert dat 1-TbAd kan worden gebruikt als een medicijn tegen malaria. "Maar ook, gericht op de productie van 1-TbAd zou M. tuberculosis in de macrofagen kunnen doden. Het enzym Rv3378c zou een interessant doelwit zijn voor de ontdekking van geneesmiddelen, omdat het enzym uniek is voor de tuberculosebacterie."
 Onderzoekers komen op de golflengte van de consument met InSb-technologie
Onderzoekers komen op de golflengte van de consument met InSb-technologie Een kunstmatig blad gemaakt van halfgeleidende polymeren
Een kunstmatig blad gemaakt van halfgeleidende polymeren Smartphone-sensoren kunnen cannabishigh detecteren en hebben de potentie om vroegtijdig in te grijpen
Smartphone-sensoren kunnen cannabishigh detecteren en hebben de potentie om vroegtijdig in te grijpen Een nieuw potentieel alternatief voor muggenbestrijding ontdekt
Een nieuw potentieel alternatief voor muggenbestrijding ontdekt De toekomst fabriceren met een nieuwe milieuvriendelijke polymerisatiemethode
De toekomst fabriceren met een nieuwe milieuvriendelijke polymerisatiemethode
Hoofdlijnen
- Wat is een prehistorische toolkit en hoe zou het de menselijke geschiedenis kunnen herschrijven?
- Cannabis kweken met moderne wetenschap en technologie
- Hoe kan ik honing uit een wilde bijenkorf extraheren?
- De definitie van moleculaire celbiologie
- Zijn getrouwde mensen gelukkiger dan alleenstaanden?
- Net als mensen, honden bleken onrustig te slapen na negatieve ervaringen
- Hoe biologische antropologie werkt
- Hoe lijken mitochondriën en chloroplasten op bacteriën?
- Warme wateren in het noordwesten trekken paaiende vissen naar het noorden
- Orale medicijnen ontwikkelen die efficiënter werken

- Een nieuw oplosmiddelsysteem:Hydrothermisch gesmolten zout
- Wetenschappers kijken naar vogelveren om kleuren af te drukken

- Stoffen gezichtsmaskers die kunnen worden gedesinfecteerd door zonlicht

- Met 2D-materialen kunnen elektrische voertuigen 500 mijl afleggen op één lading
 Flow Hive 2 ziet zoet succes in het aanbieden van nieuwe functies voor honing van de tap
Flow Hive 2 ziet zoet succes in het aanbieden van nieuwe functies voor honing van de tap Afbeelding:Saturnus ijzige maan Mimas
Afbeelding:Saturnus ijzige maan Mimas De zeespiegel kan meer dan drie meter stijgen, toont nieuwe studie
De zeespiegel kan meer dan drie meter stijgen, toont nieuwe studie Duo van titanische sterrenstelsels vastgelegd in een extreme samensmelting van sterren
Duo van titanische sterrenstelsels vastgelegd in een extreme samensmelting van sterren Ondersteuning van leidinggevenden die cruciaal zijn voor het welzijn van werknemers en de gereedheid van het personeel
Ondersteuning van leidinggevenden die cruciaal zijn voor het welzijn van werknemers en de gereedheid van het personeel Roterende sterrenstelsels in overvloed:nieuwe resultaten van ALPINE onthullen wat lijkt op spiraalstelsels in het baby-universum
Roterende sterrenstelsels in overvloed:nieuwe resultaten van ALPINE onthullen wat lijkt op spiraalstelsels in het baby-universum Google gaat de strijd aan om de markt voor cloudgaming
Google gaat de strijd aan om de markt voor cloudgaming Onderzoekers onderzoeken de correlatie tussen wind en golfhoogte in de Noordelijke IJszee
Onderzoekers onderzoeken de correlatie tussen wind en golfhoogte in de Noordelijke IJszee
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | German | Dutch | Norway | Portuguese | Danish |

-
Wetenschap © https://nl.scienceaq.com

