
Wetenschap
Elegante theorie laat zien hoe water helpt bij het scheiden van ionen die betrokken zijn bij materiaalsynthese en productie
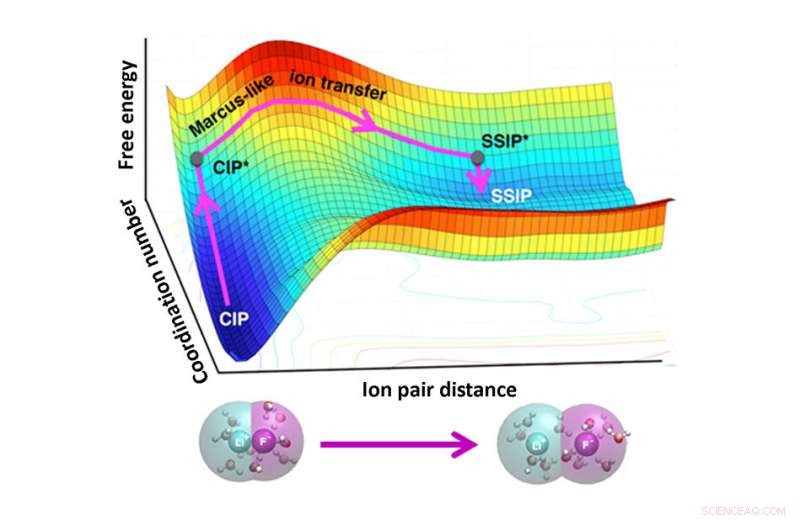
De scheiding (onderkant) van lithiumfluoride (Li en F) ionenparen omvat twee fasen:(1) een toename van de watercoördinatie rond de ionen (contactionenparen, CIP naar CIP*) en (2) ruimtelijke scheiding van de ionen (CIP* naar oplosmiddelgescheiden ionenparen, SSIP*). Zoals de bovenste grafiek laat zien, de vrije energie wordt gedomineerd door het proces van herschikking van oplosmiddelen zoals de Marcus-theorie van elektronenoverdracht. Krediet:American Chemical Society
Binnen brandstofcellen, batterijen, en biologische systemen, ionenparen in water kunnen chemische reacties beïnvloeden. Meer weten over hoe water deze reacties beïnvloedt, zou nuttig kunnen zijn. Theoretici ontwierpen een eenvoudige, elegante methode die de invloed verklaart. Hun methode laat zien hoe water rond ionen beweegt en ervoor zorgt dat ze naar elkaar toe trekken of uit elkaar blijven.
Ionenparing kan een belangrijke factor zijn in chemische en biologische processen. Het verbinden van ionen omvat complexe bewegingen van netwerken gemaakt van watermoleculen. De aanpak van het team biedt inzicht in ionen en hoe ze paren. De resultaten zullen wetenschappers laten voorspellen, controle, en stem de structuur af, functie, en dynamiek van ionen en gerelateerde processen.
De associatie of dissociatie van ionenparen in water is aanwezig in chemische reacties in brandstofcellen, batterijen, en menselijke cellen. Wetenschappers hebben moeite gehad om te begrijpen hoe watermoleculen die zich rond de ionen clusteren, de reacties beïnvloeden. De uitdaging? Traditionele rekenmodellen bevatten vaak te veel informatie om de gewenste features te onthullen. Een team van theoretici ontwierp een eenvoudig, elegante methode die laat zien hoe water rond ionenparen beweegt en beïnvloedt of ze samentrekken of uit elkaar blijven. Om de theorie voor ionenparen te ontwikkelen, het team onderzocht de afstand tussen de ionen en het aantal watermoleculen rond het individuele ion of het ionenpaar.
De aanpak toepassen, het team onthulde dat ionendissociatie in twee fasen plaatsvindt. Eerst, er is een toename van het aantal watermoleculen rond elk ion. Tweede, de ionen bewegen uit elkaar. Om ionen samen te voegen, watermoleculen moeten uit de weg gaan. Waterverplaatsing is de kritische, snelheidsbeperkende stap. Het raamwerk van het team is gebaseerd op de theorie van Marcus, oorspronkelijk ontworpen om te berekenen hoe snel elektronen tussen moleculen in oplossingen worden overgedragen en later uitgebreid naar andere transformaties. De methode van het team biedt een beter begrip van ionenparen waarmee onderzoekers de structuur kunnen controleren en afstemmen, functie, en dynamiek van ionenparen in verschillende systemen, van de interacties van eiwitten met DNA tot de beweging van ionen in batterijen.
 Bomcyclonen - de intense winterstormen die de VS (en ook Australië) troffen
Bomcyclonen - de intense winterstormen die de VS (en ook Australië) troffen Wereldwijde scheepvaartindustrie stemt ermee in de CO2-uitstoot tegen 2050 te halveren
Wereldwijde scheepvaartindustrie stemt ermee in de CO2-uitstoot tegen 2050 te halveren Noordse landen roepen op tot wereldwijd verdrag tegen plasticvervuiling in de oceaan
Noordse landen roepen op tot wereldwijd verdrag tegen plasticvervuiling in de oceaan Voordelen en nadelen van Honeybees
Voordelen en nadelen van Honeybees Nieuw satellietsysteem zou het waterkwaliteitsbeheer in Australië verbeteren
Nieuw satellietsysteem zou het waterkwaliteitsbeheer in Australië verbeteren
Hoofdlijnen
- Verschillende soorten microscopen en hun gebruik
- Migratie loont voor zangvogels
- Nieuw onderzoek benadrukt de noodzaak om te leren van klimaatveranderingen uit het verleden
- Wat is de vloeistof die de ruimte tussen de kern en het celmembraan vult?
- Het effect van temperatuur op celmembranen
- Drie soorten vezelig bindweefsel
- Verschillen en overeenkomsten tussen Unicellular & Cellular
- Wat zijn lange ketens van aminozuren genaamd?
- Genotype & Phenotype Definitie
- Zeer selectieve membranen:onderzoekers ontdekken hoe water zijn eigen filtratie kan beïnvloeden
- Nieuwe ID-foto's van geleidende polymeren ontdekken een verrassende ABBA-fan

- Hoog-thermoresistente biopolyimiden worden in water oplosbaar zoals zetmeel
- Wat is de standaardmethode voor kalibratie van een geleidbaarheidsmeter?
- Vergroening van biomaterialen en steigers die worden gebruikt in regeneratieve geneeskunde

 Hoe het repareren van het Hubble-ruimtevaartuig werkt
Hoe het repareren van het Hubble-ruimtevaartuig werkt  Gaan roodharigen uitsterven?
Gaan roodharigen uitsterven?  Romeinse bronzen ketel opgegraven in grafsteen in centraal Noorwegen
Romeinse bronzen ketel opgegraven in grafsteen in centraal Noorwegen Kijk hoe 's werelds hoogste glazen brug wordt voorgehamerd
Kijk hoe 's werelds hoogste glazen brug wordt voorgehamerd  NSA vindt grote beveiligingsfout in Windows 10, gratis fix uitgegeven
NSA vindt grote beveiligingsfout in Windows 10, gratis fix uitgegeven Robots leren taken van mensen
Robots leren taken van mensen Transplantatiebeschadigend virus komt in beeld
Transplantatiebeschadigend virus komt in beeld Hoe te begrijpen Cognitieve vaardigheden Test (CogAT) Scores op basisscholen
Hoe te begrijpen Cognitieve vaardigheden Test (CogAT) Scores op basisscholen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

