
Wetenschap
Wetenschappers simuleren de intracellulaire omgeving van een lichtgevende bacteriecel
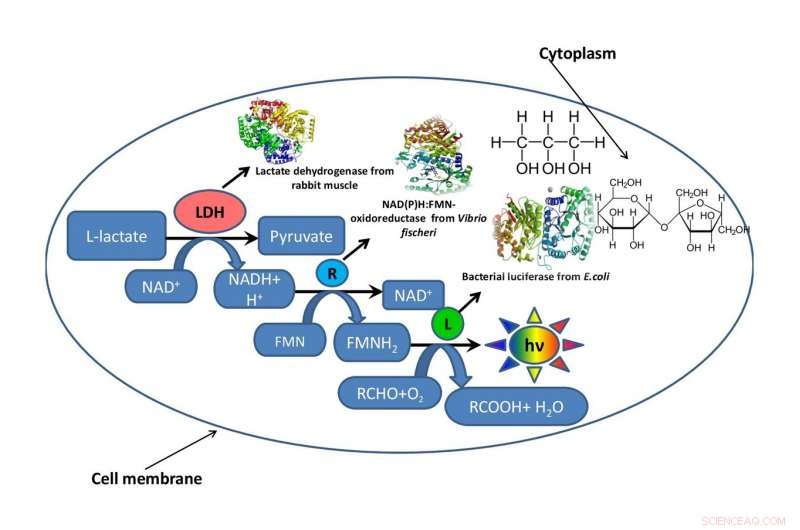
Een schema van een bacteriële cel met een fragment van een metabole keten die erin functioneert, omringd door glycerol of sucrose die de intracellulaire omgeving imiteert. Krediet:Oleg Sutormin.
Een team van het Instituut voor Fundamentele Biologie en Biotechnologie van SFU gebruikte glycerol en sucrose om de intracellulaire omgeving van lichtgevende bacteriën te simuleren en voerde een aantal enzymatische reacties uit. Ze hopen fragmenten van metabole ketens met verschillende lengtes te ontwikkelen en fermentatieve reacties te bestuderen in omstandigheden die dicht bij intracellulair liggen. Het onderzoek is gepubliceerd in de Moleculaire Katalyse logboek.
In cellen vinden voortdurend honderden reacties plaats waarbij enzymen betrokken zijn. Om ze nader te bestuderen, wetenschappers proberen uitgebreide experimentele modellen van de intracellulaire omgeving te creëren. Een interessant kenmerk van dergelijke kunstmatige omgevingsmodellen is de mogelijkheid om hun parameters aan te passen om te begrijpen hoe een bepaalde enzymatische reactie zou reageren en de verschillen tussen enzymreacties in een cel en die in buisomstandigheden.
Om te begrijpen hoe de viscositeit van het reactiemengsel de snelheid van enzymatische processen beïnvloedt, een team van het Institute of Fundamental Biology and Biotechnology van SFU simuleerde de intracellulaire omgeving met behulp van twee organische oplosmiddelen:glycerol en sucrose. Om het effect van de viscositeit van het reactiemengsel te testen, de wetenschappers gebruikten een fragment van een bioluminescente metabole keten.
Het werk bestond uit drie fasen. Op de eerste etappe, de biofysici ontwikkelden verschillende kunstmatige modelsystemen gemaakt van glycerol en sucrose met verschillende concentraties van componenten, maar dezelfde viscositeitsniveaus van het reactiemedium. Op de tweede etappe, ze bepaalden hoe de viscositeit van het reactiemengsel de snelheid van een enzymatische reactie in het gekoppelde systeem van drie enzymen beïnvloedde:LDH, NAD(P)H:FMN-oxidoreductase, en luciferase. Op de derde etappe, de onderzoekers evalueerden de thermische stabiliteit van het drievoudige enzymsysteem bij temperaturen van 15 tot 80 graden.
Als resultaat van de studie, de wetenschappers concludeerden dat sucrose de mobiliteit van de enzymen efficiënter beperkte dan glycerol. Mobiliteitsbeperking kan leiden tot veranderingen in de reactiesnelheid of zelfs het mechanisme. De onderzoekers bevelen verder onderzoek aan naar de toenemende thermische stabiliteit van enzymen in omgevingen met viskeuze reactiemengsels en toenemende temperatuur. Ze stellen ook een benadering voor om de cellulaire multi-enzym metabole ketens in de lichtgevende bacteriecel te construeren.
"Vanwege het enorme aantal enzymenreacties in een echte cel, om het metabolismeproces daarbinnen snel en continu door te laten gaan, enzymen moeten een hoge coöperativiteit hebben. Daarom, hoe meer de thermische stabiliteit van enzymen verandert in aanwezigheid van viscogenen, hoe beter de samenwerking van bestudeerde enzymsystemen in de reële celomstandigheden, en hoe groter de kans dat een kunstmatig fragment van een metabole keten natuurlijk zou zijn voor een bacteriële cel. Het is uiterst belangrijk om de invloed van viskeuze organische oplosmiddelen op de snelheid en thermische stabiliteit van enzymatische reacties te bestuderen. Het unieke van onze studie is dat we natuurlijke verbindingen gebruiken - glycerol en sucrose die daadwerkelijk in de echte cel worden gevonden, in tegenstelling tot crowding agents die in soortgelijke onderzoeken door andere onderzoekers worden gebruikt, " zegt Oleg Sutormin, een co-auteur van de studie, en junior onderzoeksmedewerker van het Laboratory of Bioluminescent Biotechnologies van SFU.
 Koperkatalysator zorgt voor een zeer efficiënte omzetting van CO2 naar brandstoffen
Koperkatalysator zorgt voor een zeer efficiënte omzetting van CO2 naar brandstoffen Onderzoekers bereiken thermochemiluminescentie in vaste toestand met kristallen
Onderzoekers bereiken thermochemiluminescentie in vaste toestand met kristallen Bio-ingenieurs zetten stap in de richting van een patch die een gebroken hart kan herstellen
Bio-ingenieurs zetten stap in de richting van een patch die een gebroken hart kan herstellen Fysieke eigenschappen van Freon 12
Fysieke eigenschappen van Freon 12  Gebruik van witte azijn en isopropylalcohol
Gebruik van witte azijn en isopropylalcohol
Hoofdlijnen
- Waarom zijn de roze meren van Australië roze?
- Minder herkauwen, meer vergroening van de brandstof
- Atrazine verandert de sex-ratio in Blanchards krekelkikkers
- Zullen we binnenkort uitgestorven zijn?
- Wat is een homologe eigenschap?
- Vergelijking voor glucosemetabolisme
- Chimpstudie onthult hoe de hersenstructuur onze evolutie heeft gevormd
- Honden zijn expressiever als iemand kijkt
- Natuurbeschermers moeten het Hollywood-effect benutten om dieren in het wild te helpen
- 3D-geprinte elektroden maken het gas vrij

- Onderzoek details regulering van een multi-drug transporter

- Chemische verbindingen in voedingsmiddelen kunnen een belangrijk SARS-CoV-2-enzym remmen

- Wetenschappers stellen nieuwe bifunctionele katalysatoren voor op van biomassa afgeleide koolstof
- Doorstroomelektroden maken waterstof 50 keer sneller

 Hoge zelfbeschadiging onder gedetineerde asielzoekers roept op tot actie
Hoge zelfbeschadiging onder gedetineerde asielzoekers roept op tot actie Winnaars van klimaatverandering zijn mogelijk financiële compensatie verschuldigd aan vervuilers
Winnaars van klimaatverandering zijn mogelijk financiële compensatie verschuldigd aan vervuilers Overal het beheer verbeteren
Overal het beheer verbeteren De onmogelijke rotatie van Saturnus begrijpen
De onmogelijke rotatie van Saturnus begrijpen Afbeelding:NASA-satelliet ziet schaduw van manen boven Patagonië
Afbeelding:NASA-satelliet ziet schaduw van manen boven Patagonië Polyethyleen brandvertragend maken
Polyethyleen brandvertragend maken Beheersing van de magnetische eigenschappen van complexe oxidesystemen
Beheersing van de magnetische eigenschappen van complexe oxidesystemen Studie van nevel IRAS 00500+6713 suggereert dat zijn centrale ster anders is dan ooit tevoren
Studie van nevel IRAS 00500+6713 suggereert dat zijn centrale ster anders is dan ooit tevoren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

