
Wetenschap
Cellulaire klepstructuur opent potentiële nieuwe therapieën
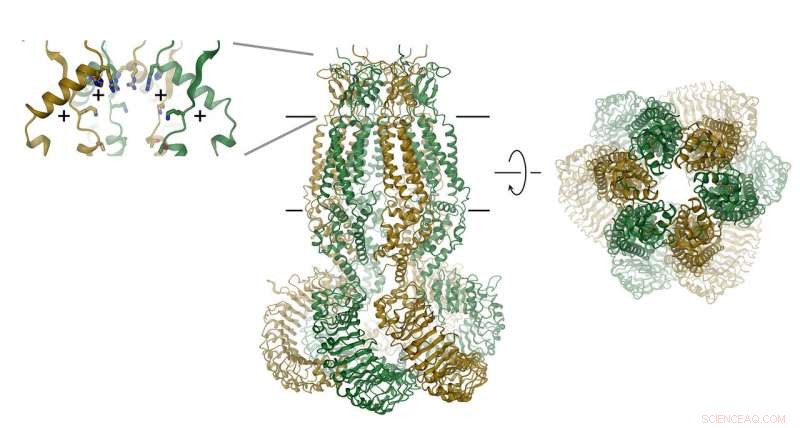
het eiwit, die bestaat uit zes subeenheden, wordt weergegeven als een lint. De positie van het membraan is aangegeven met lijnen. Het selectiviteitsfilter wordt weergegeven als inzet (rechts). De posities van positief geladen aminozuren zijn aangegeven met (+). Krediet:Raimund Dutzler, UZH
Biochemici van de Universiteit van Zürich hebben de gedetailleerde structuur van een volumegereguleerd chloridekanaal bepaald. Deze cellulaire klep wordt geactiveerd als reactie op zwelling om te voorkomen dat de cel barst. Het eiwit speelt ook een belangrijke rol bij de opname van chemotherapeutica en het vrijkomen van neurotransmitters na een beroerte. De gecontroleerde regulatie van zijn activiteit opent dus een veelbelovende strategie voor nieuwe therapieën.
Menselijke cellen zijn omgeven door membranen en zijn in osmotisch evenwicht met hun omgeving. Als de concentratie van opgeloste moleculen (osmolariteit) in de vloeistof rond de cellen afneemt, cellen beginnen te zwellen; in extreme gevallen, hierdoor kunnen de cellen barsten. Om dit te voorkomen, cellen activeren volume-gereguleerde chloridekanalen (VRAC's) van de LRRC8-eiwitfamilie. Als het celvolume toeneemt als gevolg van instromend water, deze cellulaire kleppen gaan open om de negatief geladen chloride-ionen en ongeladen osmolyten naar buiten te laten stromen, het terugbrengen van de cel naar zijn oorspronkelijke staat.
Hoewel pas vijf jaar geleden ontdekt, belangrijke eigenschappen van deze cellulaire kleppen zijn reeds beschreven. Bijvoorbeeld, het is bekend dat, naast hun rol in de volumeregeling, VRAC's spelen een belangrijke rol bij de opname van geneesmiddelen die worden gebruikt bij kankertherapie en zijn verantwoordelijk voor de ongecontroleerde afgifte van neurotransmitters na een beroerte. Ondanks deze vorderingen, de moleculaire samenstelling van VRAC's en de basis voor hun selectiviteit is ongrijpbaar gebleven. Onderzoekers van de afdeling Biochemie van de Universiteit van Zürich hebben dit hiaat in ons begrip nu gedicht. Met behulp van cryo-elektronenmicroscopie en röntgenkristallografie, het team onder leiding van prof. Raimund Dutzler heeft de gedetailleerde moleculaire structuur van een VRAC bepaald. In aanvulling, de onderzoekers analyseerden de functionele eigenschappen van het eiwit door middel van elektrofysiologische technieken.
VRAC's bestaan uit zes subeenheden, die zijn gerangschikt rond een as die de ionenpermeatieporie definieert. het eiwit, die zich in het membraan bevindt, bevat een klein extracellulair en een groot intracellulair domein. Dit laatste speelt waarschijnlijk een belangrijke rol bij kanaalactivering. Het extracellulaire domein vernauwt het kanaal en fungeert als selectiviteitsfilter. "De positieve resten in dit filter trekken negatief geladen chloride-ionen aan en laten hun permeatie toe terwijl grotere moleculen de cel niet binnenkomen, " legt Raimund Dutzler uit.
Met hun werk, de UZH-wetenschappers hebben een basis gelegd voor een beter begrip van de moleculaire mechanismen die ten grondslag liggen aan de controle van het celvolume. "Deze kennis biedt een waardevolle basis voor de ontwikkeling van potentiële nieuwe geneesmiddelen, " zegt Dutzler. In het geval van cerebrale ischemie of beroerte, de astrocyten in de hersenen zwellen op. De resulterende ongecontroleerde uitstroom van de neurotransmitter glutamaat, die wordt gemedieerd door VRAC's, heeft nadelige gevolgen voor de getroffen mensen. Dergelijke gevallen kunnen baat hebben bij de ontwikkeling van specifieke blokkers. Een andere mogelijke toepassing heeft betrekking op de rol van VRAC's bij kankertherapie:een celspecifieke activering van VRAC's zou de opname van therapieën in kankercellen kunnen verbeteren.
 3D-geprinte weefsels en organen zonder de steigers
3D-geprinte weefsels en organen zonder de steigers Kubusvormige ijzer-zwavelclusters ondersteunen meervoudige binding tussen ijzer en stikstof
Kubusvormige ijzer-zwavelclusters ondersteunen meervoudige binding tussen ijzer en stikstof Op hydrogel gebaseerde capsules kunnen dagenlang uitzetten en in het maagdarmkanaal blijven, langzaam medicatie afgeven
Op hydrogel gebaseerde capsules kunnen dagenlang uitzetten en in het maagdarmkanaal blijven, langzaam medicatie afgeven Voorkomen van roest met coatings
Voorkomen van roest met coatings  Onderzoekers ontwikkelen nieuw clip-on-apparaat voor smartphones om sperma te analyseren
Onderzoekers ontwikkelen nieuw clip-on-apparaat voor smartphones om sperma te analyseren
 Nieuw model laat zien hoe diamantdragende rotsen zich vormden in Noord-Alberta
Nieuw model laat zien hoe diamantdragende rotsen zich vormden in Noord-Alberta Plastic maakt deel uit van de koolstofkringloop en moet worden meegenomen in klimaatberekeningen
Plastic maakt deel uit van de koolstofkringloop en moet worden meegenomen in klimaatberekeningen IJsplateaus bezwijken onder het gewicht van smeltwatermeren
IJsplateaus bezwijken onder het gewicht van smeltwatermeren Toekomst van Lake Tahoe duidelijkheid in kwestie als bosbranden verergeren
Toekomst van Lake Tahoe duidelijkheid in kwestie als bosbranden verergeren Ruslands Baikalmeer extreem vervuild, Poetin waarschuwt
Ruslands Baikalmeer extreem vervuild, Poetin waarschuwt
Hoofdlijnen
- Onderzoekers demonstreren een technische benadering om medicijnen te combineren, controle parasitaire wormen
- Een 3D-model van een plantencel bouwen
- Europese zeebaars vertoont chronische verslechtering na blootstelling aan ruwe olie
- Onderzoekers identificeren moleculaire motor die chromosomen transformeert
- Hoe kunnen er pitloze druiven zijn? Hoe kunnen ze zich voortplanten?
- Duurzaamheid van visserij gekoppeld aan genderrollen onder handelaren
- Video:Op weg naar nul honger wereldwijd
- Wat is lachtherapie?
- Critici slaan VS over import van olifantentrofeeën
- Onderzoekers ontwikkelen nieuwe röntgendetectietechnologie

- Brandstofcellen met turbocompressor met een multifunctionele katalysator

- Drie overeenkomsten tussen een verbinding en een element

- Extreme kou kan de dynamiek van herpesvirusinfecties onthullen
- 3D-kweken van hepatocyten op een lever-op-een-chip-apparaat
 Wetenschappers creëren atomaire schaal, 2-D elektronisch kagome-rooster
Wetenschappers creëren atomaire schaal, 2-D elektronisch kagome-rooster Migrerende sneeuwgrens speelt een buitensporige rol bij het bepalen van het tempo van het smelten van Groenlandse ijs
Migrerende sneeuwgrens speelt een buitensporige rol bij het bepalen van het tempo van het smelten van Groenlandse ijs Zinkverbinding in veiliger dakopvangregen
Zinkverbinding in veiliger dakopvangregen Wetenschappers verbeteren diagnose alvleesklierkanker met multifunctionele platina-nanoreactor
Wetenschappers verbeteren diagnose alvleesklierkanker met multifunctionele platina-nanoreactor Wanneer menselijke chatbots de plank misslaan in interacties met de klantenservice
Wanneer menselijke chatbots de plank misslaan in interacties met de klantenservice Biodiesel maken met groene oplosmiddelen
Biodiesel maken met groene oplosmiddelen Raketafval is een risico voor de voedselzekerheid van de Inuit
Raketafval is een risico voor de voedselzekerheid van de Inuit Tropische cyclonen in de Arabische Zee:waarom nemen ze toe?
Tropische cyclonen in de Arabische Zee:waarom nemen ze toe?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

