
Wetenschap
De heilige graal van peptidechemie:peptide-actieve stoffen oraal beschikbaar maken
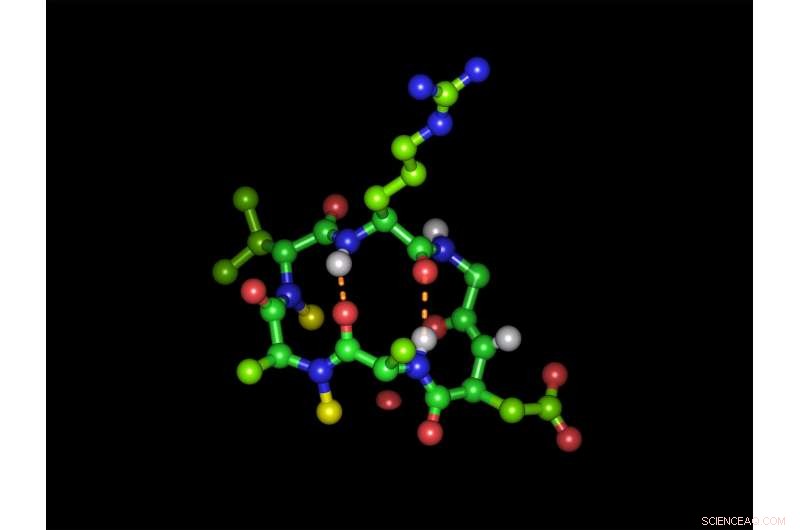
Cyclisch hexapeptide in zijn bioactieve vorm met de integrine-bindende tripeptide-sequentie arginine-glycine-asparaginezuur:Groene bollen stellen koolstofatomen voor, rode zuurstofatomen, blauwe stikstofatomen en witte waterstofatomen. Gele bollen vertegenwoordigen de twee N-methylgroepen en onderbroken oranje lijnen geven de twee intramoleculaire waterstofbruggen weer. Arrangement (met de klok mee):arginine (boven), glycine, asparaginezuur, alanine, N-gemethyleerde alanine, N-gemethyleerde D-valine. Krediet:Michael Weinmueller / TUM
peptiden, korte aminozuurketens die veel functies in het menselijk lichaam regelen, een miljardenmarkt vertegenwoordigen. Maar normaal gesproken, op peptide gebaseerde medicijnen moeten worden geïnjecteerd. Een onderzoeksteam onder leiding van de Technische Universiteit van München (TUM) heeft nu bepaald hoe peptiden kunnen worden ontworpen voor toediening als vloeistof of tablet.
Peptiden zijn korte ketens van aminozuren. In het menselijk lichaam, ze controleren diverse functies als signaalmoleculen. Bekende voorbeelden zijn insuline, die 51 aminozuurbouwstenen omvat en het metabolisme van suiker regelt, of ciclosporine, een peptide van elf aminozuren waarvan is bewezen dat het orgaanafstoting na transplantaties onderdrukt.
"Peptiden zijn uitstekend geschikt als medicijn, " zegt Horst Kessler, Carl von Linde Professor aan het Institute for Advanced Study aan de TU München. "Het lichaam gebruikt ze al als signaalmoleculen, en als ze hun werk hebben gedaan, ze kunnen door het lichaam worden gerecycled - geen ophoping, geen ingewikkelde ontgifting."
Wereldwijd, er zijn momenteel ongeveer 500 op peptiden gebaseerde medicijnen in klinische onderzoeken. Een handvol peptidemedicijnen genereert al miljarden inkomsten. Maar het feit dat ze niet als tablet kunnen worden toegediend, is een beslissend nadeel van bijna alle stoffen in deze categorie. Omdat eiwitten een belangrijk onderdeel van de voeding zijn, de maag en darmen herbergen talloze enzymen die peptidebindingen verbreken. Geen enkel medicijn op basis van ongewijzigde peptiden zou een kans hebben om de passage door het maagdarmkanaal te overleven.
Maar zelfs wanneer op de juiste wijze gemodificeerde peptideverbindingen intact door de maag komen, een andere hindernis wacht hen:de cellen van de darmwanden voorkomen dat ze in het bloed worden opgenomen. Daarom worden dit soort werkzame stoffen over het algemeen alleen per injectie toegediend. Het team benaderde deze uitdagingen in eerste instantie met behulp van een ringvormig modelpeptide. Het bestond uit zes moleculen van het eenvoudigste aminozuur, alanine. De wetenschappers gebruikten het om te onderzoeken welk effect het vervangen van waterstofatomen van de peptidebindingen door methylgroepen heeft op de orale beschikbaarheid.
Dit resulteerde in meer dan 50 variaties. Cellulaire tests door samenwerkingspartners in Israël toonden aan dat alleen specifieke peptidevarianten zeer snel worden opgenomen. "Het blijkt dat cyclische hexapeptiden met een specifieke structuur een bestaand transportsysteem kunnen gebruiken, ", zegt prof. Kessler. Het team koos integrinereceptoren die verschillende functies op het celoppervlak regelen als doelwit voor hun peptiden. Een sequentie van de drie aminozuren arginine, glycine en asparaginezuur zijn de sleutel tot de koppeling aan deze receptoren. De medewerkers van Kessler hebben de sleutelsequentie op verschillende posities van hun modelpeptide opgenomen, waardoor nieuwe varianten ontstaan.
Echter, zowel de negatief geladen zijketen van asparaginezuur als het positief geladen arginine bleken knock-out criteria voor het gebruik van het transportsysteem. Het team slaagde er desondanks in om de geladen groepen van beide aminozuren te maskeren met beschermende groepen. Hoewel hiermee het peptide aanvankelijk zijn vermogen om aan het doelmolecuul te binden verliest, als de juiste beschermende groepen zijn geselecteerd, ze worden weer afgesplitst door enzymen die alomtegenwoordig zijn in het bloed. Het farmaceutische effect wordt dus hersteld bij aankomst op hun bestemming.

Medeauteurs Dr. Florian Reichart, Dr. Andreas Rader, Michael Weinmueller en Prof. Horst Kessler (vlnr) in het laboratorium van de Technische Universiteit van München. Krediet:Uli Benz / TUM
Bewijs van mondelinge beschikbaarheid
Uit celtesten blijkt dat het nieuwe hexapeptide inderdaad een biologische werking heeft. In lage doseringen stimuleert het de groei van bloedvaten. Wanneer muizen het gemaskeerde hexapeptide krijgen, het effect is hetzelfde als bij degenen die werden geïnjecteerd met het ontmaskerde hexapeptide. "Vroeger, deskundigen hebben de orale beschikbaarheid van op peptiden gebaseerde medicijnen bestempeld als de 'heilige graal van de peptidechemie'. Ons werk biedt een strategie voor het oplossen van de uitdagingen van stabiliteit, opname in het lichaam en biologische effectiviteit, ", zegt Kessler. "In de toekomst, dit zal de creatie van peptidemedicatie die gemakkelijk in vloeibare of tabletvorm kan worden gegeven, aanzienlijk vereenvoudigen."
De communicatie tussen de cellen van een lichaam in de verschillende organen is een essentiële voorwaarde voor het bestaan van meercellige organismen. Receptoren op het celoppervlak, de zogenaamde integrines, spelen hier een belangrijke rol. Ze brengen informatie over de omgeving van een cel naar het celinterieur.
tumoren, bijvoorbeeld, sturen groeisignalen naar bloedvatcellen om ze te laten groeien en zo de bloedtoevoer naar de tumor veilig te stellen. In aanvulling, slecht functionerende integrines zijn de oorzaak van veel ziekten, waardoor ze zeer interessant zijn voor farmaceutische onderzoekers.
De rol van de herkenningsreeks
Van de 24 menselijke integrines, acht subtypes herkennen een kleine sequentie die slechts drie aminozuren bevat:arginine, glycine, en asparaginezuur (afgekort:Arg-Gly-Asp, afkorting:RGD).
Deze structuur past als een sleutel in de integrinereceptor. Signaalmoleculen en eiwitten die deze sequentie hebben, veroorzaken een reactie van de cel. Samen met andere aminozuren die een herkenningsrol vervullen, de ruimtelijke structuur van de reeks bepaalt bij welke van de integrines de sleutel past.
Farmaceutische onderzoekers zijn nu op zoek naar moleculen die deze herkenningssequenties hebben in de passende ruimtelijke structuur, waardoor ze dezelfde celreacties kunnen veroorzaken. Het vermogen om verschillende subtypes van integrine specifiek aan te pakken, is een belangrijke stap in de richting van gepersonaliseerde geneeskunde waarin alle soorten kanker op patiëntspecifieke basis kunnen worden bestreden.
 Milieuwetenschappers noemen de noodzaak van onderzoeken naar de impact van microplastics
Milieuwetenschappers noemen de noodzaak van onderzoeken naar de impact van microplastics Blijft onze schone lucht bestaan na COVID-19? Studie zegt dat het mogelijk is
Blijft onze schone lucht bestaan na COVID-19? Studie zegt dat het mogelijk is Nadelen bij het kweken van vis
Nadelen bij het kweken van vis  Zes belangrijke punten over de regel voor betaalbare schone energie
Zes belangrijke punten over de regel voor betaalbare schone energie Onderzoek onthult ongelijkheden in koolstofvoetafdruk van Chinese huishoudens
Onderzoek onthult ongelijkheden in koolstofvoetafdruk van Chinese huishoudens
Hoofdlijnen
- Wat is het dominante fenotype?
- Onderzoekers richten zich op invasieve, verderfelijke gevlekte lantaarnvlieg
- Robotapparaat volgt plantengroei op cellulair niveau
- Het Bohr-model:snel vervangen maar nooit vergeten
- Wetenschappers zoeken naar overlevenden nadat de Thomas-brand een condorreservaat heeft verschroeid
- Onderzoeksartikelen werpen licht op een decennium lang stamcelmysterie
- Wilt u 41 procent van de zeer bedreigde gewervelde planeten redden? Werken op eilanden
- Vier belangrijke soorten chromosomen
- Hoe MRNA naar TRNA
- Het natuurlijke vermogen van hout gebruiken om te buigen tijdens het drogen om gebogen structuren te creëren

- Een onderzoek naar de instabiliteit van het rozenvenster

- Computermodel met hoge doorvoer voorspelt diffusiegegevens voor het transport van lichte elementen in vaste stoffen

- Laat de europium helderder schijnen

- Klein worden om te bepalen waar nucleair materiaal vandaan komt en hoe het is gemaakt

 Hoe wegwerken het veranderen van huis is
Hoe wegwerken het veranderen van huis is Turen door de wolken van Earths Evil Twin verrast NRL-hemelwachters
Turen door de wolken van Earths Evil Twin verrast NRL-hemelwachters Machine learning voorspelt black-outs veroorzaakt door stormen
Machine learning voorspelt black-outs veroorzaakt door stormen COVID-19 laat zien waarom rijkdom ertoe doet
COVID-19 laat zien waarom rijkdom ertoe doet Wat is de PH van een suikeroplossing?
Wat is de PH van een suikeroplossing?  Telegram moet FSB-coderingssleutels geven:Russische rechtbank
Telegram moet FSB-coderingssleutels geven:Russische rechtbank Naarmate de temperatuur stijgt, boeren planten gewassen in S.Koreaanse tunnel
Naarmate de temperatuur stijgt, boeren planten gewassen in S.Koreaanse tunnel Wat hebben planten nodig om fotosynthese uit te voeren?
Wat hebben planten nodig om fotosynthese uit te voeren?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com

