
Wetenschap
Chemici lossen hardnekkig probleem op na vier decennia

Credit:Universiteit Leiden
Na bijna vier decennia, Leidse en Eindhovense scheikundigen hebben de discussie over het juiste model met betrekking tot de eenvoudigste chemische reactie in heterogene katalyse opgelost, wat essentieel is voor brandstofcellen. Met behulp van een uniek gebogen platina-oppervlak, Ludo Juurlink en Ph.D. kandidaat Richard van Lent uit Leiden en Michael Gleeson van DIFFER lieten zien welk model de reactie van waterstof correct beschrijft. Ze publiceerden hun bevindingen in Wetenschap op 11 januari.
Al bijna vier decennia woedt er in de chemische literatuur een verhit debat:welke van de twee bestaande modellen voor de reactie van waterstof op een platinakatalysator is correct (zie kader)? Traditionele methoden waren niet voldoende om dit te bewijzen. Leids chemicus Ludo Juurlink en Michael Gleeson van het Dutch Institute for Fundamental Energy Research (DIFFER) besloten een nieuwe methode te ontwikkelen om sluitend bewijs te leveren, wat een succes bleek te zijn.
De twee bestaande modellen voor heterogene katalyse geven verschillende voorspellingen over hoe de reactie van waterstof afhangt van de structuur van het platina-oppervlak. Door middel van metingen konden de onderzoekers de reactiviteit van waterstof bepalen en zo aantonen welk model correct is. Het gekromde platinakristal was daarbij cruciaal, die voor het eerst werd gemaakt door een Nederlands bedrijf in Zaandam. "Omdat het platina-oppervlak gekromd is, de atomaire structuur verandert heel geleidelijk langs het oppervlak, " legt Juurlink uit. "Je kunt deze constructie vergelijken met een trap, waarvan de stappen naar de randen steeds smaller worden. In het midden lijkt het meer op een balzaal." Het bleek dat de reactiviteit van waterstof lineair afhankelijk was van hoe dicht de treden bij elkaar staan. Hoe verder de treden uit elkaar stonden, hoe minder reactief waterstof was. "En dus is het model dat een niet-lineair gedrag voorspelde onjuist, " hij zegt.
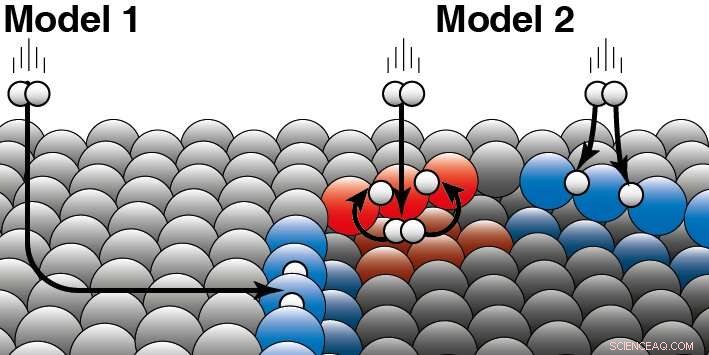
Een katalysator versnelt een chemische reactie zonder te worden verbruikt. Bij heterogene katalyse, de katalysator is gewoonlijk een vaste stof en de reactanten een gas of vloeistof. Juurlink legt het verschil tussen de twee modellen uit:'De twee modellen zijn gebaseerd op verschillende aannames over hoe kinetische energie van het waterstofmolecuul 'weglekt' tijdens de botsing met het platina-oppervlak.' Om dit te verduidelijken, hij geeft een voorbeeld:'Als een hond in een ijsgat zit, hij kan daar op twee manieren terecht zijn gekomen. Of hij gleed vanaf de zijkant over het ijs en viel in het ijsgat, of hij sprong direct vanaf de zijkant in het ijsgat.' Uit hun onderzoek blijkt nu dat waterstofmoleculen vooral direct uit de gasfase reageren aan de traprand van platina (Model 2). Model 1, dat veronderstelt dat de meeste moleculen aan de randen belanden door over het platte platina oppervlak te 'schaatsen' en pas dan te reageren klopt dus niet. De onderzoekers zagen verschillen tussen de twee verschillende soorten randen (rood en blauw) die van nature voorkomen op platinakatalysatoren. Waterstof kan op de boven- of onderkant van zo'n rand terechtkomen. Voor beide soorten stapranden, de onderzoekers kunnen beslissen welk deel direct op de bovenzijde reageert (zoals weergegeven in blauw) of eerst op de onderzijde belandt (zoals in rood). Credit:Universiteit Leiden
Het onderzoek is uitgevoerd in ultrahoog vacuüm en levert belangrijke inzichten op. "We weten nu beter hoe we de snelheid van chemische reacties moeten berekenen - een van de modellen draagt niet significant bij, ", zegt Juurlink. "Daarnaast we weten nu dat deze gebogen kristaloppervlakken een unieke, nieuwe kans om te leren hoe chemische reacties daadwerkelijk plaatsvinden op oppervlakken. Daar gaan we zeker meer onderzoek mee doen."
Bijna alle grote chemische industriële processen maken gebruik van heterogene katalyse. Katalysatoren zijn soms duur en zeldzaam, zoals platina, een veel voorkomende katalysator die wordt aangetroffen in brandstofcellen en uitlaatsystemen van auto's. "Het ongebruikelijke is dat we meestal niet eens echt weten hoe en waarom dergelijke katalysatoren chemische reacties versnellen, ", zegt Juurlink. Beter inzicht in dit hoe en waarom zal bijdragen aan het verduurzamen van de chemische industrie. "Op basis van een beter begrip van wat er op atomair niveau gebeurt, we kunnen nieuwe katalysatoren ontwikkelen, ", zegt Juurlink. "Katalysatoren die minder energieverlies veroorzaken en minder afhankelijk zijn van dure en zeldzame materialen."
 Boombedekking is niet genoeg:om steden koel te houden, is een op commons gebaseerde klimaatrespons nodig
Boombedekking is niet genoeg:om steden koel te houden, is een op commons gebaseerde klimaatrespons nodig Het klimaat (niet de mens) vormde de vroege bossen van New England
Het klimaat (niet de mens) vormde de vroege bossen van New England De andere reden om af te stappen van steenkool:luchtvervuiling die jaarlijks duizenden slachtoffers maakt
De andere reden om af te stappen van steenkool:luchtvervuiling die jaarlijks duizenden slachtoffers maakt Methode in de lucht om noordelijke meren en hun verband met klimaatverandering te begrijpen
Methode in de lucht om noordelijke meren en hun verband met klimaatverandering te begrijpen Onderzoekers bestuderen muggenplaag in afvalwaterzuiveringsinstallaties in Ohio
Onderzoekers bestuderen muggenplaag in afvalwaterzuiveringsinstallaties in Ohio
Hoofdlijnen
- Whodunnit, als Aussie-reptielen uitsterven:studie (update)
- Kwallen hebben superkrachten - en andere redenen waarom ze hun slechte reputatie niet verdienen
- Oesters sluiten hun schelpen als reactie op laagfrequente geluiden
- Antiverouderingsbehandelingen - The Science of Living Longer
- Nieuwe studies zijn bedoeld om sociaalwetenschappelijke methoden in natuurbehoudonderzoek te stimuleren
- Belangrijke feiten over het koninkrijk Monera
- Evolutionaire relaties tussen prokaryoten en eukaryoten
- Herziening van historische voorraadroutes kan zeldzame stukken inheemse planten en dieren in gevaar brengen
- De Atlantische steuren verblijven
- Niet-invasieve microscopie detecteert de activeringsstatus en maakt onderscheid tussen celtypen

- Wetenschappers bieden perspectieven op cavitatiewetenschap

- Nieuwe productiemethode voor fullereenkristal 50 keer sneller dan zijn voorganger

- Materiaalchemici tappen lichaamswarmte af om slimme kleding van stroom te voorzien

- Studie onthult nieuwe bevindingen over synergie van antimicrobiële geneesmiddelen
 Gezondheidsvolgsensor voor huisdieren en mensen bewaakt vitale functies door middel van bont of kleding
Gezondheidsvolgsensor voor huisdieren en mensen bewaakt vitale functies door middel van bont of kleding Ladingsoverdracht binnen geanalyseerde overgangsmetaalkleurstoffen
Ladingsoverdracht binnen geanalyseerde overgangsmetaalkleurstoffen Verse SAS wee als stakingsgronden 110, 000 reizigers
Verse SAS wee als stakingsgronden 110, 000 reizigers Soorten knaagdieren in California
Soorten knaagdieren in California Veldproeven valideren de impact van het zogstuur van windturbines op schaal
Veldproeven valideren de impact van het zogstuur van windturbines op schaal Groenlandse landschapsgeschiedenis bewaard onder ijskap
Groenlandse landschapsgeschiedenis bewaard onder ijskap Onderzoekers maken plastic film die het coronavirus onderdrukt
Onderzoekers maken plastic film die het coronavirus onderdrukt muren versterken, levens redden
muren versterken, levens redden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

