
Wetenschap
Suiker aan eiwit plakken
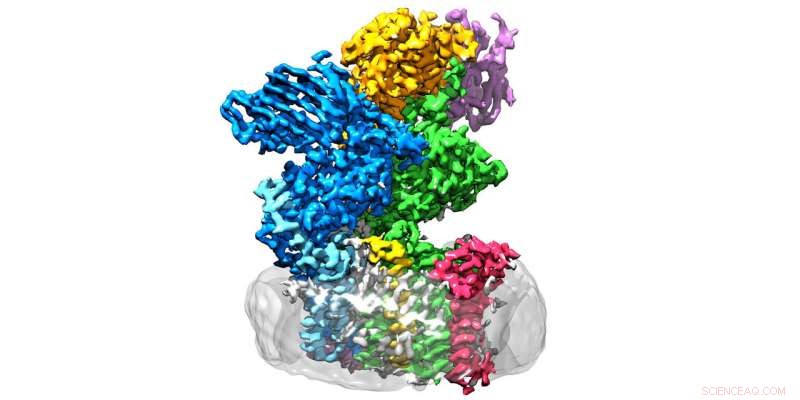
Het enzym oligosaccharyltransferase bevindt zich in het membraan (grijs) en bestaat uit acht subeenheden. Krediet:Julia Kowal / ETH Zürich
ETH-onderzoekers zijn erin geslaagd de 3D-structuur te bepalen van het enzym dat suikerketens aan eiwitten hecht - een doorbraak die ze onlangs in het tijdschrift publiceerden Wetenschap .
Wanneer cellen signalen ontvangen, interageren met andere cellen of virussen en bacteriën identificeren, het proces omvat niet alleen eiwitten, maar ook suikerketens die aan hun oppervlak zijn bevestigd. Het onderwerp dat tot nu toe relatief weinig aandacht kreeg, deze structuren verschillen sterk in samenstelling en vertakking, en lijken te helpen ervoor te zorgen dat eiwitten correct vouwen en in staat zijn om hun specifieke taken uit te voeren.
Verschillende observaties tonen het belang van de suikerachtige aanhangsels aan:identieke eiwitten met verschillende suikerketens hebben verschillende functies, zieke en gezonde cellen hebben verschillende suikersamenstellingen op hun oppervlak, en drugs waaraan ze gehecht zijn, worden blijkbaar beter verdragen.
Hoe komt de suiker op het eiwit?
Bekend als glycanen, deze stoffen zijn momenteel het onderwerp van intensief onderzoek. Na genomics en proteomics, er is nu ook glycomics. Het opkomende onderzoeksgebied van de glycobiologie houdt zich bezig met biosynthese, structuur en de diverse functies van de suikerachtige aanhangsels. Een belangrijke vraag is hoe de diverse reeks suikermoleculen in de eerste plaats de eiwitten bereikt.

Cryo-elektronenmicroscoopbeelden van het enzym. Krediet:Rebekka Wild / ETH Zürich
ETH-onderzoekers in de groepen onder leiding van Kaspar Locher van het Institute of Molecular Biology and Biophysics en Markus Aebi van het Institute of Microbiology hebben nu een beslissende stap voorwaarts gezet op dit gebied:ze hebben de driedimensionale structuur van oligosaccharyltransferase (OST) bepaald in gist. "Dit is het enzym dat eiwitten verbindt met suikerbomen, " legt Rebekka Wild uit, een van de drie hoofdauteurs van het rapport in Wetenschap waarin de ETH-onderzoekers hun bevindingen presenteren.
Het bepalen van de structuur van OST was niet eenvoudig:om te beginnen, Jilliane Eyring, de derde hoofdauteur van het rapport, gemodificeerde de gistcellen zodat het enzym kon worden gericht en gezuiverd. Wild moest eerst het enzym extraheren, die is ingebed in een membraan in de cel, uit grote hoeveelheden van deze gistcellen en zuiveren deze vervolgens in een moeizame procedure. "Negen liter gist produceerde ongeveer 0,2 milligram enzym, " zegt ze. De OST-moleculen werden op een klein raster aangebracht, als individu ingevroren, afzonderlijke deeltjes en afgebeeld met behulp van een cryo-elektronenmicroscoop met hoge resolutie.
Dit leverde duizenden afbeeldingen op die het enzymcomplex vanuit elke mogelijke kijkhoek lieten zien. Van deze afbeeldingen, Julia Kowal, de tweede hoofdauteur, genereerde de driedimensionale structuur van OST. Het duurde zes weken om de berekeningen op het computercluster uit te voeren. Het resultaat was een elektronendichtheidskaart die het enzym laat zien als een "elektronenwolk".
"We hebben een geluksmoment aangegrepen, " legt Wild uit. Ze konden profiteren van de "resolutierevolutie" die momenteel plaatsvindt in de cryo-elektronenmicroscopie en gebruikmaken van een ultramodern apparaat met atomaire resolutie. De ontwikkeling van deze technologie werd bekroond met de Nobelprijs in scheikunde in 2017.
Om de elektronenmicroscopiegegevens te interpreteren, Wild moest de aminozuursequentie van OST "handmatig" in de kleine wolken in de driedimensionale kaart passen. Dus, de onderzoeker was in staat om de 3D-structuur van OST tot in detail weer te geven - een doorbraak die onder onderzoekers met verrukking werd begroet nadat deze online was gepubliceerd.
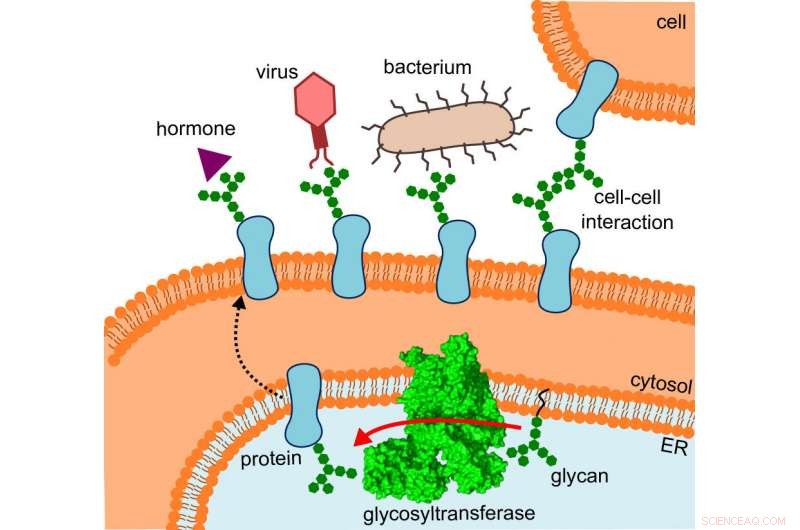
Het diagram laat zien waar de glycosyltransferase zich bevindt, de route die de gewijzigde eiwitten nemen en de interacties die ze ondergaan. Krediet:R. Wild / ETH Zürich
OST is een membraaneiwitcomplex dat bestaat uit acht subeenheden, die identificeren, bijvoorbeeld, de suiker- of eiwitsubstraten of de katalytische eenheid stabiliseren. De laatste is de subeenheid van het enzym dat het actieve centrum herbergt, waar eiwitten en suikers worden samengebracht en versmolten. "We hadden verwacht dat de katalysator zich in het midden van het enzym zou bevinden, " legt Wild uit. "Verrassend genoeg echter, het zit aan de buitenkant - en de vorm doet denken aan een wijd open mond."
Wat de onderzoekers aanvankelijk in de war had gebracht, werd plotseling logisch, omdat ze de structuur inpasten op de locatie waar OST daadwerkelijk opereert:in het bijzonder, het enzym is in vivo ingebed in het membraan van het endoplasmatisch reticulum (ER). Dit is het deel van de cel waar eiwitten worden geproduceerd, gevouwen, gecontroleerd en aangepast.
Hier, De directe buur van de OST is een tunneleiwit - zoveel was al bekend. Dit leidt de jonge eiwitten naar het binnenste van het endoplasmatisch reticulum en vervolgens rechtstreeks naar de wijd open mond van de OST, waar ze hun kleine suikerboompjes ontvangen.
"Gist OST is een goed model voor de processen bij mensen, " legt Wild uit. De onderzoekers trekken deze conclusie uit het feit dat het actieve centrum van gist OST, waar de eiwitten zijn voorzien van suikers, lijkt sterk op het overeenkomstige gebied in bacteriën. "Dit betekent dat het actieve centrum in de loop van de evolutie nauwelijks is veranderd, " legt de onderzoeker uit, "wat betekent dat er een goede kans is dat het nog steeds op een vergelijkbare manier werkt bij zoogdieren, en dus ook bij de mens."
 De code voor roetvorming kraken - wetenschappers ontrafelen mysterie om gevaarlijke emissies te helpen verminderen
De code voor roetvorming kraken - wetenschappers ontrafelen mysterie om gevaarlijke emissies te helpen verminderen Sensoren ontwerpen om vreemde lichamen in voedsel te detecteren
Sensoren ontwerpen om vreemde lichamen in voedsel te detecteren Wetenschappers suggereren een milieuvriendelijke manier om zeer actieve katalysatoren te verkrijgen
Wetenschappers suggereren een milieuvriendelijke manier om zeer actieve katalysatoren te verkrijgen De eigenschappen van zure stoffen
De eigenschappen van zure stoffen  Veiligheidsmaatregelen voor het gebruik van een pipet
Veiligheidsmaatregelen voor het gebruik van een pipet
 Hebben extreme schommelingen in zuurstof, geen geleidelijke stijging, de Cambrische explosie veroorzaken?
Hebben extreme schommelingen in zuurstof, geen geleidelijke stijging, de Cambrische explosie veroorzaken? Wetenschappers schijnen licht op kleine kristallen achter onverwachte gewelddadige uitbarstingen
Wetenschappers schijnen licht op kleine kristallen achter onverwachte gewelddadige uitbarstingen Evoluerende perspectieven op abrupte seizoensveranderingen van de algemene circulatie
Evoluerende perspectieven op abrupte seizoensveranderingen van de algemene circulatie Egyptische graancirkels
Egyptische graancirkels Koepels van bevroren methaan kunnen waarschuwingssignalen zijn voor nieuwe blow-outs
Koepels van bevroren methaan kunnen waarschuwingssignalen zijn voor nieuwe blow-outs
Hoofdlijnen
- Onderzoek naar het verleden van aardappelen kan de spuds van de toekomst verbeteren
- Een lijst met vijf kenmerken van chromosomen
- Wat is een voorbeeld in een levend systeem van hoe moleculair van vorm is?
- Verbeteringen in de cryo-elektronenmicroscopie brengen het leven op atomair niveau duidelijker in beeld
- Drie mechanismen van genetische recombinatie in prokaryoten
- Hoe werken Mexicaanse springbonen?
- Drie redenen waarom de celdeling belangrijk is
- Wat breekt een dubbele helix van DNA af?
- De schimmels onder zijn de grote ontbinders
- Chemische agentia met vertrouwen detecteren

- Zoutzuur verhoogt de activiteit van de katalysator

- Het blootleggen van een sleutelmechanisme in de assemblage van het aviaire sarcoomvirus, een 100 jaar oud oncogeen virus dat vaak wordt gebruikt om hiv-1 te bestuderen
- Test op levensbedreigend voedingstekort wordt gemaakt van ingewanden van bacteriën

- Inktvishuid zou de oplossing kunnen zijn om materiaal te camoufleren

 Supercomputers helpen bij het ontwerpen van gemuteerd enzym dat plastic flessen eet
Supercomputers helpen bij het ontwerpen van gemuteerd enzym dat plastic flessen eet Dalende luchtpakketten behoren tot de oorzaken van hete perioden
Dalende luchtpakketten behoren tot de oorzaken van hete perioden Sporen van opiaten gevonden in oud Cypriotisch schip
Sporen van opiaten gevonden in oud Cypriotisch schip Initiële motivatie is een sleutelfactor voor het leren in massale open online cursussen
Initiële motivatie is een sleutelfactor voor het leren in massale open online cursussen Gemuteerd kikkergen stoot roofdieren af
Gemuteerd kikkergen stoot roofdieren af Peptide induceert chiraliteitsevolutie in een enkel gouden nanodeeltje
Peptide induceert chiraliteitsevolutie in een enkel gouden nanodeeltje Een betere manier om atoomkrachtmicroscopie te gebruiken om moleculen in 3-D . af te beelden
Een betere manier om atoomkrachtmicroscopie te gebruiken om moleculen in 3-D . af te beelden Rusland wijt incident in ruimtestationlab aan softwarefout
Rusland wijt incident in ruimtestationlab aan softwarefout
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

