Wetenschap
Het nieuwe peptide van biologen kan veel kankers bestrijden
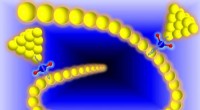
MIT-biologen hebben een nieuw peptide ontworpen dat een belangrijk eiwit kan verstoren dat veel soorten kanker, waaronder sommige vormen van lymfoom, leukemie, en borstkanker, nodig hebben om te overleven. Krediet:Chelsea Turner/MIT
MIT-biologen hebben een nieuw peptide ontworpen dat een belangrijk eiwit kan verstoren dat veel soorten kanker, waaronder sommige vormen van lymfoom, leukemie, en borstkanker, nodig hebben om te overleven.
Het nieuwe peptide richt zich op een eiwit genaamd Mcl-1, die kankercellen helpt de cellulaire zelfmoord te voorkomen die gewoonlijk wordt veroorzaakt door DNA-schade. Door Mcl-1 te blokkeren, het peptide kan kankercellen dwingen om geprogrammeerde celdood te ondergaan.
"Sommige kankercellen zijn erg afhankelijk van Mcl-1, wat de laatste verdedigingslinie is die voorkomt dat de cel sterft. Het is een zeer aantrekkelijk doelwit, " zegt Amy Keating, een MIT-professor biologie en een van de senior auteurs van de studie.
peptiden, of kleine eiwitfragmenten, zijn vaak te onstabiel om als drugs te gebruiken, maar in deze studie de onderzoekers ontwikkelden ook een manier om de moleculen te stabiliseren en ze te helpen in doelcellen te komen.
Loren Walenski, een professor in kindergeneeskunde aan de Harvard Medical School en een arts aan het Dana-Farber Cancer Institute, is ook een senior auteur van de studie, die verschijnt in de Proceedings van de National Academy of Sciences de week van 15 januari. Onderzoekers in het lab van Anthony Letai, een universitair hoofddocent geneeskunde aan de Harvard Medical School en Dana-Farber, waren ook betrokken bij het onderzoek, en de hoofdauteur van het artikel is MIT-postdoc Raheleh Rezaei Araghi.
Een veelbelovend doelwit
Mcl-1 behoort tot een familie van vijf eiwitten die een rol spelen bij het beheersen van geprogrammeerde celdood, of apoptose. Elk van deze eiwitten is overactief gebleken bij verschillende soorten kanker. Deze eiwitten vormen een zogenaamde "apoptotische blokkade, " wat betekent dat cellen geen apoptose kunnen ondergaan, zelfs wanneer ze DNA-schade ervaren die normaal celdood zou veroorzaken. Hierdoor kunnen kankercellen ongecontroleerd overleven en zich vermenigvuldigen, en lijkt een belangrijke manier te zijn waarop cellen resistent worden tegen chemotherapiemedicijnen die DNA beschadigen.
"Kankercellen hebben veel strategieën om in leven te blijven, en Mcl-1 is een belangrijke factor voor veel acute myeloïde leukemieën en lymfomen en sommige vaste weefselkankers zoals borstkanker. Expressie van Mcl-1 is opgereguleerd in veel kankers, en het werd opgereguleerd als een resistentiefactor tegen chemotherapie, ' zegt Keating.
Veel farmaceutische bedrijven hebben geprobeerd medicijnen te ontwikkelen die gericht zijn op Mcl-1, maar dit was moeilijk omdat de interactie tussen Mcl-1 en zijn doeleiwit plaatsvindt in een lange reeks van 20 tot 25 aminozuren, die moeilijk te blokkeren is met de kleine moleculen die gewoonlijk als medicijnen worden gebruikt.
Peptide medicijnen, anderzijds, kan worden ontworpen om stevig te binden met Mcl-1, voorkomen dat het interageert met zijn natuurlijke bindingspartner in de cel. Het lab van Keating heeft vele jaren besteed aan het ontwerpen van peptiden die zouden binden aan het deel van Mcl-1 dat bij deze interactie betrokken is, maar niet aan andere leden van de eiwitfamilie.
Toen ze een paar veelbelovende kandidaten hadden gevonden, kwamen ze een ander obstakel tegen, dat is de moeilijkheid om peptiden in cellen te krijgen.
"We waren manieren aan het onderzoeken om peptiden te ontwikkelen die selectief binden, en daar waren we zeer succesvol in, maar toen werden we geconfronteerd met het probleem dat onze korte, peptiden met 23 residuen zijn geen veelbelovende therapeutische kandidaten, voornamelijk omdat ze niet in cellen kunnen komen, ' zegt Keating.
Om dit te proberen te boven te komen, ze werkte samen met Walensky's lab, die eerder hadden aangetoond dat het "nieten" van deze kleine peptiden ze stabieler kan maken en hen kan helpen om in cellen te komen. Deze nietjes, die bestaan uit koolwaterstoffen die verknopingen vormen binnen de peptiden, kan normaal floppy eiwitten induceren om een stabielere helixstructuur aan te nemen.
Keating en collega's creëerden ongeveer 40 varianten van hun Mcl-1-blokkerende peptiden, met nietjes in verschillende posities. Door deze allemaal te testen, ze identificeerden één locatie in het peptide waar het plaatsen van een nietje niet alleen de stabiliteit van het molecuul verbetert en het helpt in de cellen te komen, maar maakt het ook nog hechter aan Mcl-1.
"Het oorspronkelijke doel van het nietje was om het peptide in de cel te krijgen, maar het blijkt dat het nietje ook de binding kan verbeteren en de specificiteit kan verbeteren, "zegt Keating. "Dat hadden we niet verwacht."
Kankercellen doden
De onderzoekers testten hun top twee Mcl-1-remmers in kankercellen die afhankelijk zijn van Mcl-1 om te overleven. Ze ontdekten dat de remmers deze kankercellen zelf konden doden, zonder extra medicijnen. Ze ontdekten ook dat de Mcl-1-remmers erg selectief waren en geen cellen doodden die afhankelijk zijn van andere leden van de eiwitfamilie.
Keating zegt dat er meer tests nodig zijn om te bepalen hoe effectief de medicijnen kunnen zijn bij het bestrijden van specifieke kankers, of de medicijnen het meest effectief zijn in combinatie met anderen of alleen, en of ze moeten worden gebruikt als eerstelijnsgeneesmiddelen of wanneer kankers resistent worden tegen andere geneesmiddelen.
"Ons doel was om genoeg proof-of-principle te doen zodat mensen zullen accepteren dat geniete peptiden in cellen kunnen komen en op belangrijke doelen kunnen werken. De vraag is nu of er dierstudies gedaan kunnen worden met ons peptide die verdere validatie zouden bieden , " ze zegt.
Jozua Kritzer, een universitair hoofddocent scheikunde aan de Tufts University, zegt dat de studie bewijs levert dat de stapled peptide-benadering de moeite waard is en zou kunnen leiden tot nieuwe medicijnen die interfereren met specifieke eiwitinteracties.
"Er zijn veel biologen en biochemici geweest die essentiële interacties van eiwitten hebben bestudeerd, met de rechtvaardiging dat met meer begrip van hen, we zouden medicijnen kunnen ontwikkelen die ze remmen. Dit werk toont nu een directe lijn van biochemisch en biofysisch begrip van eiwitinteracties naar een remmer, " zegt Kritzer, die niet bij het onderzoek betrokken was.
Keating's lab ontwerpt ook peptiden die kunnen interfereren met andere verwanten van Mcl-1, waaronder een genaamd Bfl-1, die minder is bestudeerd dan de andere leden van de familie, maar ook betrokken is bij het blokkeren van apoptose.
Dit verhaal is opnieuw gepubliceerd met dank aan MIT News (web.mit.edu/newsoffice/), een populaire site met nieuws over MIT-onderzoek, innovatie en onderwijs.
 Energieonderzoekers breken de katalytische snelheidslimiet
Energieonderzoekers breken de katalytische snelheidslimiet Chemieprojecten met citroen
Chemieprojecten met citroen  UCI-wetenschappers zijn de eersten om te observeren, afbeelding allerbelangrijkste moleculaire trillingen
UCI-wetenschappers zijn de eersten om te observeren, afbeelding allerbelangrijkste moleculaire trillingen Onderzoekers ontwikkelen stof die SARS-CoV-2 door contact kan elimineren
Onderzoekers ontwikkelen stof die SARS-CoV-2 door contact kan elimineren Machine learning-analyse van röntgengegevens selecteert belangrijke katalytische eigenschappen
Machine learning-analyse van röntgengegevens selecteert belangrijke katalytische eigenschappen
 Tarwe en bankgras kunnen giftige metalen uit verontreinigde grond halen
Tarwe en bankgras kunnen giftige metalen uit verontreinigde grond halen Wat doen haviken?
Wat doen haviken?  NASA kijkt naar Daniels geconcentreerde centrum
NASA kijkt naar Daniels geconcentreerde centrum Het smelten van de permafrost in het noordpoolgebied zal het broeikaseffect verergeren
Het smelten van de permafrost in het noordpoolgebied zal het broeikaseffect verergeren Video:Antarctische ontdekkingsreiziger en poolbioloog bespreekt een van de grootste ijsbergbreuken in de geschiedenis
Video:Antarctische ontdekkingsreiziger en poolbioloog bespreekt een van de grootste ijsbergbreuken in de geschiedenis
Hoofdlijnen
- Hoe het Curiosity-project werkt
- Een DNA-model maken met piepschuimballen
- Hoe planten hun zaden vormen
- De positieve kant van een besmettelijk eiwit:stresssensoren bevorderen de overleving van gistcellen
- De circadiane klok bepaalt het tempo van de plantengroei
- Epigenetische reostaat onthult hoe genregulatie wordt geërfd en onderhouden
- Gene drives hebben het potentieel om muggenpopulaties te onderdrukken, maar resistente muggen duiken op
- Zullen we binnenkort uitgestorven zijn?
- Onderzoekers richten zich op invasieve, verderfelijke gevlekte lantaarnvlieg
 Verminderde afvoer van sneeuwsmelt in Sierra Nevada om de landbouw in Californië te bedreigen
Verminderde afvoer van sneeuwsmelt in Sierra Nevada om de landbouw in Californië te bedreigen Zichtbaar licht-geïnduceerde bifunctionele rhodium katalyse ontwikkeld voor decarbonylatieve koppeling van imiden met alkynen
Zichtbaar licht-geïnduceerde bifunctionele rhodium katalyse ontwikkeld voor decarbonylatieve koppeling van imiden met alkynen Natuurkundigen observeren lang gezocht fenomeen op nanoschaal
Natuurkundigen observeren lang gezocht fenomeen op nanoschaal Röntgenwaarnemingen onthullen inzicht in de aard van de pulsarwindnevel 3C 58
Röntgenwaarnemingen onthullen inzicht in de aard van de pulsarwindnevel 3C 58 Onderzoekers gebruiken gewoon keukenzout als groeisjabloon voor materialen voor energieopslag
Onderzoekers gebruiken gewoon keukenzout als groeisjabloon voor materialen voor energieopslag Een zakgids voor Mars:nu kun je een atlas voor de rode planeet kopen
Een zakgids voor Mars:nu kun je een atlas voor de rode planeet kopen Levende koraalbedekking zal toekomstige rifoplossing vertragen
Levende koraalbedekking zal toekomstige rifoplossing vertragen Eta treft Cuba met harde wind, regenen
Eta treft Cuba met harde wind, regenen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com