
Wetenschap
De positieve kant van een besmettelijk eiwit:stresssensoren bevorderen de overleving van gistcellen
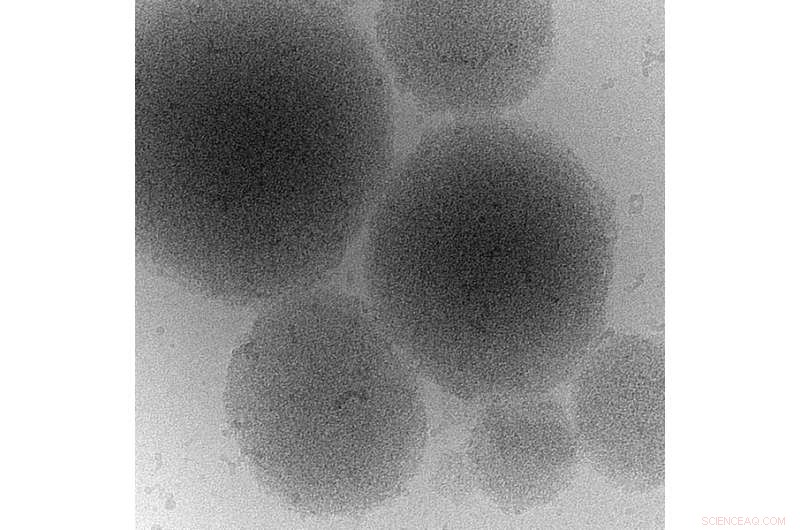
Cryo-elektronenmicroscopiebeeld van een biomoleculair condensaat van een prioneiwit. Krediet:MPI-CBG
Prionen zijn zelfpropagerende eiwitaggregaten die tussen cellen kunnen worden overgedragen. De aggregaten worden in verband gebracht met menselijke ziekten. Inderdaad, pathologische prionen veroorzaken gekkekoeienziekte en bij mensen de ziekte van Creutzfeldt-Jakob. De aggregatie van prionachtige eiwitten wordt ook geassocieerd met neurodegeneratie zoals bij ALS. De regio's binnen prionachtige eiwitten die verantwoordelijk zijn voor hun aggregatie werden prionachtige domeinen genoemd. Ondanks de belangrijke rol van prionachtige domeinen bij menselijke ziekten, een fysiologische functie is raadselachtig gebleven. Onderzoekers van het Max Planck Instituut voor Moleculaire Celbiologie en Genetica (MPI-CBG), het Biotechnologiecentrum van de TU Dresden (BIOTEC), en de Washington University in St. Louis, VS hebben nu voor het eerst een goedaardige, zij het biologisch relevante functie van priondomeinen als eiwitspecifieke stresssensoren die cellen in staat stellen zich aan te passen aan omgevingsstress en deze te overleven. Het blootleggen van de fysiologische functie is een essentiële eerste stap op weg naar het dichten van een kloof in het begrijpen van de biologische rol van priondomeinen en hun transformatie naar een pathologische ziekteveroorzakende toestand.
De ontdekkingen werden gepubliceerd in Wetenschap .
De aggregatie van prionachtige eiwitten wordt in verband gebracht met ziekten bij de mens. Hun infectieuze gedrag is vergelijkbaar met de verspreiding van een virale infectie. Dit roept de vraag op waarom evolutie deze eiwitten in stand heeft gehouden:zijn deze sequenties ergens goed voor? In hun studie hebben het team rond onderzoeksgroepleider prof. dr. Simon Alberti van het MPI-CBG richtte zich op het gistprioneiwit Sup35, die een lange geschiedenis heeft als rolmodel voor priononderzoek. Ze ontdekten dat het prion-domein van Sup35 werkt als een stresssensor die de vorming van beschermende eiwitdruppeltjes en gels activeert wanneer cellen worden blootgesteld aan zware omstandigheden.
Wanneer cellen onder stress staan, bijvoorbeeld omdat ze geen voedingsstoffen meer hebben, hun energieniveau daalt. Dit leidt tot een verlaging van de cytosolische pH-waarde - de cellen verzuren. In antwoord, celdeling stopt, het metabolisme stopt en de cellen gaan in de stand-by-modus. Als de stress voorbij is, cellen moeten hun metabolisme snel herprogrammeren en de groei en deling opnieuw starten. Prof. Simon Alberti en zijn collega's ontdekten dat het Sup35-priondomein belangrijk is voor het overleven van stress. "We ontdekten dat cellen zonder het priondomein een groeidefect vertonen wanneer ze herstellen van stress", vat Titus Franzmann samen, de eerste auteur van de studie. De wetenschappers ontdekten dat het priondomein van Sup35 de zure pH van het cytosol waarneemt en vervolgens de vorming van eiwitdruppeltjes stimuleert die Sup35 beschermen tegen schade. "Om het eiwit op te slaan kunnen de druppeltjes zelfs opschuiven tot een gelachtige structuur", zegt co-auteur Marcus Jahnel van de biofysica-groep van prof. Stephan Grill van de BIOTEC. Deze eiwitdruppels - die zich in het cytoplasma vormen, vergelijkbaar met condenserende waterdruppels - kunnen weer oplossen, waardoor de cel het Sup35-eiwit opnieuw kan gebruiken wanneer het opnieuw begint te groeien. Aanvullend, collega's van de Washington University in St. Louis voorspelden de sequenties van de aminozuren die verantwoordelijk zijn voor het waarnemen van veranderingen in de cytoplasmatische pH-waarde van Sup35. In deze context, Rohit Pappu, Edwin H. Murty hoogleraar biomedische technologie aan de Washington University, merkte op dat:"Het blootleggen van de moleculaire componenten die deze adaptieve vermogens van Sup35 verlenen, ook belangrijke implicaties heeft voor het begrijpen van cellen op moleculair niveau en het toepassen van deze principes voor het bouwen van synthetische systemen".
Vanuit een evolutionair oogpunt, de Sup35 condensaten zijn echt interessant, omdat ze bewaard zijn gebleven tussen verre verwante gisten die bijna 400 miljoen jaar geleden uiteenliepen. Dit suggereert dat druppel- en gelvorming een voorouderlijke functie van het Sup35-priondomein kan zijn. Titus Franzmann concludeert:"De studie suggereert dat priondomeinen eiwitspecifieke stresssensoren zijn die cellen in staat stellen te reageren op specifieke omgevingscondities. Op die manier kunnen we konden voor het eerst een positieve functie aantonen van een priondomein dat vaak alleen is geassocieerd met ziekteverwekkende aggregaten. Dus misschien is dat de reden waarom de evolutie ze zo lang heeft bewaard."
 Onderzoekers karakteriseren moleculaire scharen voor plastic afval
Onderzoekers karakteriseren moleculaire scharen voor plastic afval Onderzoekers identificeren de oorsprong van het metabolisme
Onderzoekers identificeren de oorsprong van het metabolisme Nieuwe technologie voor het produceren van poreus aluminium
Nieuwe technologie voor het produceren van poreus aluminium Zullen cyborgs gemaakt worden van melanine? Pigmentdoorbraak maakt biocompatibele elektronica mogelijk
Zullen cyborgs gemaakt worden van melanine? Pigmentdoorbraak maakt biocompatibele elektronica mogelijk Wetenschappers ontdekken pad naar verbetering van baanbrekende batterij-elektrode
Wetenschappers ontdekken pad naar verbetering van baanbrekende batterij-elektrode
 Houtkap en het effect ervan op het ecosysteem
Houtkap en het effect ervan op het ecosysteem Graduate research fellow onderzoekt hoe schimmels en vuur het ecosysteem van dennensavannes laten gedijen
Graduate research fellow onderzoekt hoe schimmels en vuur het ecosysteem van dennensavannes laten gedijen VS blijft stagneren in kwetsbaarheid en paraatheid voor klimaatverandering, nieuwe gegevens tonen
VS blijft stagneren in kwetsbaarheid en paraatheid voor klimaatverandering, nieuwe gegevens tonen Vulkaan Guatemala spuwt as maanden na dodelijke uitbarsting
Vulkaan Guatemala spuwt as maanden na dodelijke uitbarsting Natuurkundigen tonen aan dat interacties tussen rook en wolken een onverwacht verkoelend effect hebben
Natuurkundigen tonen aan dat interacties tussen rook en wolken een onverwacht verkoelend effect hebben
Hoofdlijnen
- Oude Egyptische zwangerschapstest overleefde millennia omdat het werkte
- Nucleic Acid Facts
- Zeeschildpadden sterven nadat ze verstrikt zijn geraakt in plastic afval
- Studie analyseert de eigenaardige schedelanatomie van brulapen
- Hoe lucide dromen werkt
- Een betere manier om pesticiden van appels te wassen
- Geërgerd door andere volkeren friemelen? Studie zegt dat je niet alleen bent
- Overeenkomsten en verschillen tussen osmose en diffusie
- Het richten op een enkel eiwit kan een breed scala aan virussen behandelen
 Google-CEO geconfronteerd met House grillen op inbreuk, Chinese censuur
Google-CEO geconfronteerd met House grillen op inbreuk, Chinese censuur Keizerspinguïns kunnen record snel inkorten door te snacken
Keizerspinguïns kunnen record snel inkorten door te snacken De transmissie van kwantuminformatie stroomlijnen
De transmissie van kwantuminformatie stroomlijnen Onderliggende winst Philips 2018 hoger na verkoop verlichting
Onderliggende winst Philips 2018 hoger na verkoop verlichting Celademhalingsexperimenten
Celademhalingsexperimenten Gedereguleerd toezicht van de Amerikaanse regering op interstatelijke wateren laat duistere gevolgen voor staten achter
Gedereguleerd toezicht van de Amerikaanse regering op interstatelijke wateren laat duistere gevolgen voor staten achter Grafeen en andere koolstofnanomaterialen kunnen schaarse metalen vervangen
Grafeen en andere koolstofnanomaterialen kunnen schaarse metalen vervangen Studie gebruikt neutronen om licht te laten schijnen op het afsluiten van kankercellen
Studie gebruikt neutronen om licht te laten schijnen op het afsluiten van kankercellen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com






