
Wetenschap
Onderzoek naar elektrolyse voor energieopslag
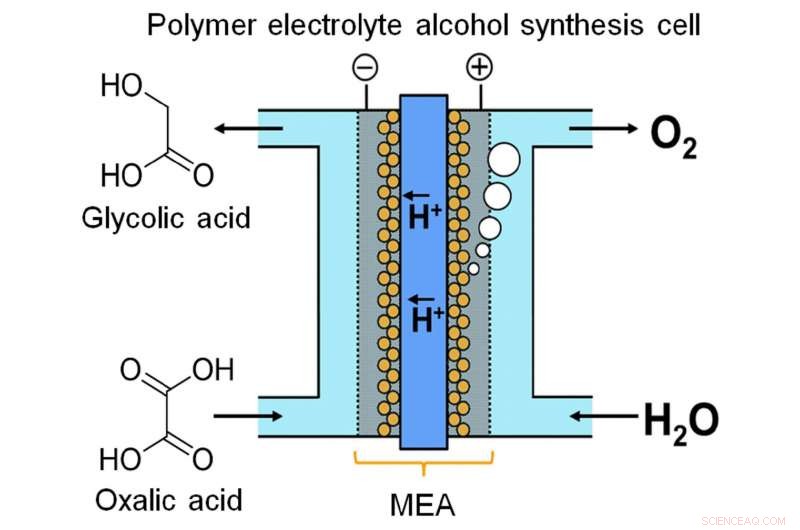
Een onderzoeksteam van Kyushu University realiseerde continue elektrochemische synthese van een alcoholische verbinding uit een carbonzuur met behulp van een elektrosynthesecel van polymeerelektrolytalcohol, die directe stroomlading in alcoholische verbinding mogelijk maakt. Krediet:Masaaki Sadakiyo / Internationaal Instituut voor koolstofneutraal energieonderzoek, Kyushu-universiteit
De belangstelling voor duurzame energie blijft groeien. Veel hernieuwbare energiebronnen, Hoewel, kan frustrerend intermitterend zijn. Als de zon verduisterd wordt door wolken, of de wind stopt met waaien, het vermogen fluctueert. Het fluctuerende aanbod kan deels worden opgevangen door energieopslag tijdens piekproductiemomenten. Echter, het opslaan van elektriciteit is niet zonder uitdagingen.
Onlangs, een team van de Kyushu University heeft een apparaat gemaakt om energie op te slaan in chemische vorm door middel van continue elektrolyse. De onderzoekers merkten op dat glycolzuur (GC) een veel grotere energiecapaciteit heeft dan waterstof, een van de meer populaire chemicaliën voor energieopslag. GC kan worden geproduceerd door vier-elektronenreductie van oxaalzuur (OX), een algemeen verkrijgbaar carbonzuur. Zoals beschreven in hun publicatie in Wetenschappelijke rapporten , het team bedacht een elektrolytische cel op basis van een nieuw membraan-elektrodesamenstel. Tussen twee elektroden bevinden zich een op iridiumoxide gebaseerde anode en een titaniumdioxide (TiO2)-gecoate titanium (Ti) kathode, verbonden door een polymeermembraan.
"Flow-type systemen zijn erg belangrijk voor energieopslag met vloeistoffasereactie, " zegt hoofdauteur Masaaki Sadakiyo. "De meeste elektrolyzers die alcoholen produceren, werken met een batchproces, die hiervoor niet geschikt is. Op ons apparaat, door gebruik te maken van een vast polymeer elektrolyt in direct contact met de elektroden, we kunnen de reactie als een continue stroom uitvoeren zonder toevoeging van onzuiverheden (bijvoorbeeld elektrolyten). De OX-oplossing kan effectief worden gezien als een stroombare elektronenpool."
Een andere belangrijke overweging is het ontwerp van de kathode. De kathodische reactie wordt gekatalyseerd door anatase TiO2. Om een stevige verbinding tussen katalysator en kathode te verzekeren, het team "groeide" TiO2 rechtstreeks op Ti in de vorm van een gaas of vilt. Elektronenmicroscoopbeelden tonen de TiO2 als een piekerige fuzz, zich aan de buitenkant van de Ti-staven vastklampen als een laag verse sneeuw. In feite, het is zijn taak om de elektroreductie van OX tot GC te katalyseren. In de tussentijd, bij de anode, water wordt geoxideerd tot zuurstof.
Het team ontdekte dat de reactie versnelde bij hogere temperaturen. Echter, het te hoog zetten van het vuur stimuleerde een ongewenst bijproces - de omzetting van water in waterstof. De ideale balans tussen deze twee effecten was bij 60°C. Bij deze temperatuur, het apparaat kan verder worden geoptimaliseerd door de stroom van reactanten te vertragen, terwijl de hoeveelheid oppervlakte die beschikbaar is voor de reactie wordt vergroot.
interessant, zelfs de textuur van de vage TiO2-katalysator maakte een groot verschil. Toen TiO2 werd bereid als een "vilt, " door het te laten groeien op dunnere en dichter opeengepakte Ti-staven, de reactie vond sneller plaats dan op het gaas - waarschijnlijk vanwege het grotere oppervlak. Het vilt ontmoedigde ook de waterstofproductie, door het Ti-oppervlak nauwer te bedekken dan het gaas, het voorkomen van de blootstelling van blote Ti.
"Onder de juiste omstandigheden onze cel zet bijna 100 procent van OX om, wat we erg bemoedigend vinden, " zegt co-auteur Miho Yamauchi. "We berekenen dat de maximale volumetrische energiecapaciteit van de GC-oplossing ongeveer 50 keer die van waterstofgas is. Om duidelijk te zijn, de energie-efficiëntie, in tegenstelling tot capaciteit, loopt nog steeds achter op andere technologieën. Echter, dit is een veelbelovende eerste stap naar een nieuwe methode voor het opslaan van overtollige stroom."
 Orkaan Ida:twee redenen voor de recordverpletterende regenval in NYC en het noordoosten lang nadat de wind was afgezwakt
Orkaan Ida:twee redenen voor de recordverpletterende regenval in NYC en het noordoosten lang nadat de wind was afgezwakt Onderzoek suggereert drie periodes van vertraging van de opwarming van de aarde sinds 1891 als gevolg van natuurlijke tijdelijke oorzaken
Onderzoek suggereert drie periodes van vertraging van de opwarming van de aarde sinds 1891 als gevolg van natuurlijke tijdelijke oorzaken Onderzoekers gebruiken teledetectie om de stikstofdepositie in Noord-China te schatten
Onderzoekers gebruiken teledetectie om de stikstofdepositie in Noord-China te schatten Verspil geen hondenpoep - composteer het
Verspil geen hondenpoep - composteer het Wat is een lichaamsfossiel?
Wat is een lichaamsfossiel?
Hoofdlijnen
- RIP Jeremy de lefty tuinslak
- Rijd naar gigantisch nieuw zeereservaat op Antarctica
- Is Rust Dust schadelijk?
- Hoe branden het gezicht van de toendra veranderen
- 5 mensen die niet begraven kunnen blijven
- Ontdekking helpt de nauwkeurigheid van CRISPR-Cas9-genbewerking te verbeteren
- Waarom is chemie belangrijk voor de studie van anatomie en fysiologie?
- De voordelen van over jezelf praten in de derde persoon
- Hoe wordt water gevormd tijdens cellulaire ademhaling?
- Zout smelt geen ijs - zo maakt het de winterse straten echt veilig

- Ongebruikelijk halfmetaal vertoont bewijs van unieke toestanden van oppervlaktegeleiding

- Hoge verwachtingen van new-age rubber:zelfherstellend materiaal heeft veel industriële toepassingen

- DNA-replicatie in HPV

- Nieuwe ontdekking kan nauwkeurige voorspelling van kankerverspreiding mogelijk maken voordat kanker zich ontwikkelt
 SRNL-stralingsdetectiesystemen in de havens van Tacoma en NY/NJ
SRNL-stralingsdetectiesystemen in de havens van Tacoma en NY/NJ Laseraanwijssysteem kan kleine satellieten helpen gegevens naar de aarde te verzenden
Laseraanwijssysteem kan kleine satellieten helpen gegevens naar de aarde te verzenden Hoe de pH van een twee-chemisch mengsel te berekenen
Hoe de pH van een twee-chemisch mengsel te berekenen Jet-aangedreven afvalwaterbehandeling
Jet-aangedreven afvalwaterbehandeling Afbeelding:bijgewerkte NASA-schadekaart van kampvuur vanuit de ruimte
Afbeelding:bijgewerkte NASA-schadekaart van kampvuur vanuit de ruimte 5 technische innovaties in de strijd tegen terrorisme
5 technische innovaties in de strijd tegen terrorisme  Onderzoekers houden stand in een touwtrekken op atoomschaal
Onderzoekers houden stand in een touwtrekken op atoomschaal Minimalisering van blootstelling aan schadelijke vlamvertragende chemicaliën in afvalschuim en kunststoffen
Minimalisering van blootstelling aan schadelijke vlamvertragende chemicaliën in afvalschuim en kunststoffen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

