
Wetenschap
Enzymen en bacteriën bewegen richting, maar bacteriën naar voedsel, enzymen weg
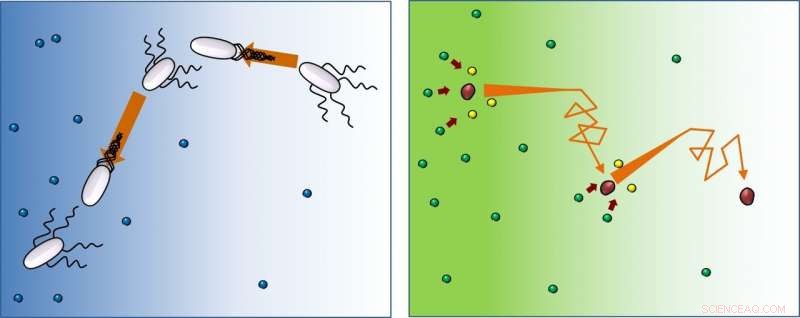
In aanwezigheid van voedsel (blauw), bacteriën (wit) zwemmen rechtdoor, verander vervolgens de oriëntatie (tuimelen), en volg dit patroon keer op keer. Deze studie laat zien dat enzymen (rood) op dezelfde manier bewegen, maar na reactie met substraten (van groen naar geel), ze blijven wegrennen van de hogere concentratie aan substraten. Krediet:IBS
Hoewel het combineren van de woorden "willekeurig" en "bevooroordeeld" een botsing kan lijken, dit zijn de attributen die beschrijven hoe bacteriën navigeren en hun voedsel halen. Ze volgen een willekeurig pad, maar bevooroordeeld in de richting van de bron van de voedingsstoffen. Wetenschappers van het Centrum voor Zachte en Levende Materie, binnen het Instituut voor Basiswetenschappen (IBS, Zuid-Korea), waargenomen dat enzymen, de moleculen die ervoor zorgen dat biologische reacties sneller plaatsvinden, bewegen met een soortgelijk patroon, maar in de tegenovergestelde route - willekeurig reizen naar het gebied met minder substraten. deze resultaten, verkregen met nieuwe optische technologieën en gepubliceerd als een eerste artikel in Proceedings van de National Academy of Sciences (PNAS) , zijn bijzonder intrigerend omdat ze afwijken van de traditionele kijk.
Duizenden enzymen bevorderen een veelheid aan reacties in ons lichaam, die elk ons leven in stand houden. Enzymen werken in op andere chemicaliën die substraten worden genoemd en versnellen chemische reacties die substraten in producten omzetten. Om dat te doen, enzymen en substraten moeten voldoen. Oorspronkelijk werd aangenomen dat enzymen en hun corresponderende substraten elkaar terloops tegen het lijf lopen:"Standaardleerboeken vermelden dat enzymen en substraten op de een of andere manier in de buurt moeten komen, "interactie, en dat is hoe reacties plaatsvinden. We hebben geprobeerd om in het 'op de een of andere manier' deel van dit proces te graven. Na duizenden gebeurtenissen te hebben verzameld, kwamen we tot de conclusie dat de loop van enzymen willekeurig bevooroordeeld is, wat betekent dat ze microscopisch gericht zijn, zoals bacteriën, " legt Ah-Young Jee uit, eerste auteur van deze studie.
De beweging van zwemmende bacteriën staat bekend als "rennen en tuimelen":rennen, draai en herhaal. Ze gaan in één richting, verander dan willekeurig van richting, en herhaal. Echter, terwijl bacteriën zich oriënteren op de voedselvoorziening, enzymen bewegen in de richting van een lagere substraatconcentratie. "Moleculen hebben geen beslissingsvermogen, maar verrassend genoeg verhuizen naar gebieden met minder substraat. Inderdaad, het substraat introduceert de richtingsbias, en hoe hoger de substraatconcentratie die we in het experiment gebruikten, hoe sterker deze neiging. We veronderstellen dat het een manier zou kunnen zijn om de productconcentratie uniform te maken rond het medium, zelfs als de substraatconcentratie dat niet is, " zegt prof. Tsvi Tlusty, die de theoretische kennis van dit onderzoek hebben geboden.
Aangezien de pas van elk enzym slechts ongeveer 50 nanometer lang is, uiterst nauwkeurige apparaten zijn nodig om hun snelheid en oriëntatie te meten. Het onderzoeksteam, onder leiding van Steve Granick, keek naar de enzymatische beweging met een superresolutiemicroscopietechnologie, bekend als gestimuleerde emissie-depletie fluorescentie correlatie spectroscopie, of kortweg STED-FCS.

A) Enzym-substraat-buffer (E+S+B) komt in de linker inlaat, en enzymbuffer (E+B) wordt in de rechterinlaat geïnjecteerd. Op deze manier, de enzymconcentratie is uniform over de hele chip, terwijl de substraatconcentratie aan de linkerkant hoger is (blauw) en geleidelijk afneemt naar rechts (wit). De rechthoek met streepjes geeft het gebied aan waar de enzymbeweging tot in detail wordt bestudeerd met behulp van STED-FCS-microscopietechnologie. B) De concentratie van het enzym urease (zwart) en de concentratie van ureum (het substraat, grijs) zijn uitgezet tegen de positie binnen de FCS-zone, tussen 0 en 2,5 millimeter van de laserstraal. De schaal op elk punt is een foutbalk, met de standaarddeviatie over vijf herhaalde metingen. C) De diffusiecoëfficiënt (Da), die aangeeft hoe snel het enzym beweegt, verandert niet bij afwezigheid van substraat, maar het neemt toe als het substraat aanwezig is, wat betekent dat het enzym sneller naar rechts beweegt. Krediet:IBS, publiceert in PNAS
Bij de FCS-methode enzymen zijn versierd met fluorescerende moleculen en hun passage door een kleine stip wordt gedetecteerd door een laserstraal. Statistische informatie wordt verzameld, zoals het aantal enzymen dat door de stip gaat en hun snelheid (diffusiesnelheid). Het team vulde FCS aan met STED-technologie, een van de sterke punten van dit onderzoekscentrum. STED concentreert de laserstraal in een extreem klein gebied, waardoor een meer verfijnde meting van de positie van de enzymen mogelijk is. De FCS-laserstraal bestrijkt een gebied van ongeveer 250 nanometer in diameter, dat is ongeveer 25 keer de diameter van het enzym (10 nanometer). STED-FCS is nauwkeuriger omdat het de bundeldiameter reduceert tot 50 nanometer, wat vergelijkbaar is met de afstand van de stap van een enzym.
De onderzoekers ontwierpen ook een nieuwe microfluidics-chip, gevormd door micrometer dikke kanalen waar vloeistoffen doorheen kunnen. Eerdere studies, FCS gebruiken zonder STED en een andere microfluidics-chip, suggereerde dat de enzymen zich verplaatsen naar het gebied met de hoogste concentratie substraat. Echter, deze nieuwe technologie maakt diepere waarnemingen mogelijk en toonde het tegenovergestelde aan. De auteurs denken dat de resultaten verschillen omdat gedetailleerde informatie over de enzymbeweging teniet werd gedaan met een grotere laserstraal. Het zou vergelijkbaar zijn met het lokaliseren van iemand binnen 50 vierkante kilometer of binnen 2 vierkante kilometer, de laatste is nauwkeuriger. Ze creëerden omstandigheden waarin het enzym gelijkmatig in de chip wordt verdeeld, maar de substraatconcentratie varieert van links naar rechts:van een minimale concentratie aan de rechterkant van de chip, naar een maximale concentratie aan de linkerkant. Vervolgens, ze gebruikten FCS om de concentratie en snelheid van het enzym in de chip te observeren, en ontdekte dat het enzym de neiging heeft te versnellen naar het gebied met een lagere substraatconcentratie (dat wil zeggen naar de rechterkant van de chip). In plaats daarvan, wanneer er geen substraat aanwezig is, de enzymen veranderen hun snelheid niet. Bovendien, de superresolutiemogelijkheden van STED-FCS vertoonden een run-and-tumble-dynamiek.
Het team observeerde hetzelfde gedrag met twee enzym-substraatparen afzonderlijk:urease-ureum en acetylcholinesterase (AChE)-acetylcholine. Het voormalige enzym wordt door sommige micro-organismen gebruikt om ureum om te zetten in ammoniak en koolzuur, de laatste speelt een essentiële rol bij neuromusculaire verbindingen.
In de toekomst, het onderzoeksteam wil de complexiteit van de studie vergroten en de testomstandigheden meer vergelijkbaar maken met het echte leven:"In deze studie werd gekeken naar het gedrag van één enzym als reactie op één substraat. Vervolgens, we zijn van plan om naar meerdere enzymen tegelijk te kijken. Ons lichaam functioneert met een cascade van reacties, wat betekent dat de ene reactie de volgende triggert:enzym A triggert enzym B, dan activeert B C, enzovoort. STED-FCS-analyse kan een belangrijk hulpmiddel zijn om metabool onderzoek vooruit te helpen door te onthullen hoe deze meerdere enzymatische systemen organisch gerelateerd zijn, " concludeert Jee.
 Een Trojaanse paardenbenadering kan leiden tot behandelingen voor sommige antibioticaresistente bacteriën
Een Trojaanse paardenbenadering kan leiden tot behandelingen voor sommige antibioticaresistente bacteriën Onderzoekers gebruiken een synthetische tong om whisky's te sorteren
Onderzoekers gebruiken een synthetische tong om whisky's te sorteren Kaliumnitraatreactie-experimenten
Kaliumnitraatreactie-experimenten  Onderzoekers stellen vast hoe sorptiematerialen koolstof vangen en afgeven
Onderzoekers stellen vast hoe sorptiematerialen koolstof vangen en afgeven Hoe de chemische zuurstofbehoefte te berekenen
Hoe de chemische zuurstofbehoefte te berekenen
 Wijnmaken in de Scandinavische landen, een wereld verwijderd van Frans chateau luxe
Wijnmaken in de Scandinavische landen, een wereld verwijderd van Frans chateau luxe Nepal getroffen door ergste bosbranden in bijna tien jaar
Nepal getroffen door ergste bosbranden in bijna tien jaar Warmste oceanen ooit kunnen een jaar van extreem weer veroorzaken
Warmste oceanen ooit kunnen een jaar van extreem weer veroorzaken We kunnen onze vis eten en ook klimaatverandering bestrijden
We kunnen onze vis eten en ook klimaatverandering bestrijden Wanneer bewoners de leiding nemen over hun regenwouden, minder bomen sterven
Wanneer bewoners de leiding nemen over hun regenwouden, minder bomen sterven
Hoofdlijnen
- Vleugelstructuur van vitaal belang bij het produceren van een reeks tonen bij paringsoproepen van bush-cricket
- Wanneer citroenen je leven geven:Herpetofauna-aanpassing aan citrusboomgaarden in Belize
- Monitoring van microben om marsonauten gezond te houden
- Team onthult regels voor het maken van ribben
- Luipaarden doden minstens 3 kinderen op het Indiase platteland
- De verbazingwekkende efficiëntie van het leven
- Scented Cleaning Products: The New Smoking?
- Hoe MRNA naar TRNA
- Een DNA-model maken met piepschuimballen
- Bacteriën uit warmwaterbronnen lossen mysterie van metabolisme op

- Wetenschappers vinden moleculaire vernietigingscode voor enzym dat betrokken is bij cholesterolproductie

- Zelfherstellende gouddeeltjes

- Wetenschappers krijgen het meest realistische beeld tot nu toe van een eiwitstructuur met spikes door het coronavirus
- Een methode om verborgen serienummers van polymeerproducten te herstellen

 Hoe de Perseus te vinden Constellation
Hoe de Perseus te vinden Constellation Kinderen leerden weinig of niets tijdens schoolsluitingen, ondanks online leren:studeren
Kinderen leerden weinig of niets tijdens schoolsluitingen, ondanks online leren:studeren Hoe zout van water te scheiden
Hoe zout van water te scheiden Wetenschappers ontdekken nieuwe toepassingen voor kleine koolstofnanobuisjes
Wetenschappers ontdekken nieuwe toepassingen voor kleine koolstofnanobuisjes Het oudste gesteente van de aarde is mogelijk ontdekt (op de maan!)
Het oudste gesteente van de aarde is mogelijk ontdekt (op de maan!)  Hoe beïnvloeden Plate Tectonics de Rock Cycle?
Hoe beïnvloeden Plate Tectonics de Rock Cycle?  Wetenschappers ontwikkelen veelbelovend nieuw type polymeer
Wetenschappers ontwikkelen veelbelovend nieuw type polymeer Hoe zes nieuwe talen te leren met uTalk
Hoe zes nieuwe talen te leren met uTalk
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

