
Wetenschap
Inzicht in enzymcascades die de sleutel zijn tot het begrijpen van het metabolisme
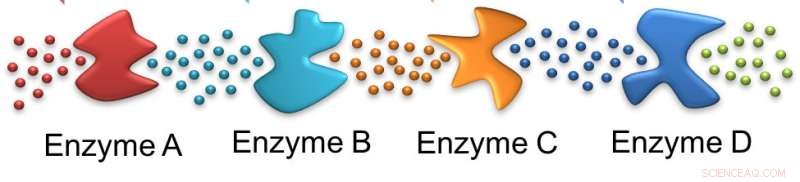
als mieren, het ene enzym volgt het spoor dat het vorige heeft achtergelaten. In dit geval, het initiële substraat wordt ingewerkt door enzym A, een substraat achterlatend dat geschikt is voor enzym B en verder langs de lijn. Krediet:Ayusman Sen, Penn State
Een lepel suiker kan ervoor zorgen dat het medicijn naar beneden gaat, maar begrijpen wat er met die suiker in de cel gebeurt, is veel ingewikkelder dan eenvoudige vertering, volgens onderzoekers. Om suikers te metaboliseren en energie te leveren aan de cellen, een reeks enzymen - biologische katalysatoren - moeten elk, beurtelings, een reactant afbreken. In dit geval, de onderzoekers gebruikten glucose, de suiker in glucosestroop en een van de twee suikers die ontstaan wanneer tafelsuiker - sucrose - in het lichaam wordt afgebroken.
In deze cascade, het eerste enzym werkt op de glucose die aan de cel wordt geleverd en de daaropvolgende enzymen werken op opeenvolgende producten. In het proces, twee adenosinetrifosfaatmoleculen - ATP - worden verbruikt, maar er worden er vier geproduceerd. De hydrolyse van ATP drijft veel cellulaire processen aan om de levensvatbaarheid van de cel te behouden. Vergelijkbare enzymcascades zijn verantwoordelijk voor veel stofwisselingsprocessen in het lichaam.
Van enzymen die deelnemen aan dergelijke reactieroutes is in sommige gevallen aangetoond dat ze intracellulaire, omkeerbare complexen genaamd metabolons door Paul Srere (overleden), Universiteit van Texas Southwestern Medical School. Door de enzymen in de buurt van elkaar te hebben, wordt de reeks reacties die ze katalyseren, vergemakkelijkt. Een voorbeeld hiervan is het purinosoom dat is ontdekt in Evan Pugh University Professor en Eberly Chair in Chemistry Stephan J. Benkovic's Lab in Penn State, dat bestaat uit zes enzymen die betrokken zijn bij de biosynthese van purines.
De onderzoekers vroegen of een van de factoren die bijdragen aan de vorming van metabolonen een gradiënt van chemicaliën zou kunnen zijn die door de deelnemende enzymen worden gegenereerd. Ze rapporteren hun resultaten in het nummer van vandaag (18 december) van Natuurchemie .
"We hebben enige tijd geleden ontdekt dat eenvoudige katalysatormoleculen zoals enzymen ook de gradiënt van een reactant chemotaxeren, " zei Ayusman Sen, voorname hoogleraar scheikunde, Penn State. "Ze gaan naar steeds hogere concentraties reactant."
De beweging wordt chemotaxis genoemd, waarbij individuele moleculen migreren langs een concentratiegradiënt van andere moleculen.
"Alle levende wezens chemotax, " zei Sen. "Als je honger hebt en plotseling frietjes ruikt, je zult proberen naar de friet te lopen. Als de geur afneemt, je draait je willekeurig om om de hogere concentratie frietgeurmoleculen te vinden totdat je bij de frietbalie bent."
In hun studie hebben de onderzoekers gebruikten alleen de eerste vier enzymen van de glycolytische route - hexokinase, fosfoglucose-isomerase, fosfofructokinase en aldolase. Deze vier stappen verbruiken eigenlijk ATP. Om de beweging van de enzymen te bestuderen, gebruikten de onderzoekers fluorescerende tagging van hexokinase en aldolase, de eerste en vierde enzymen in de route. Elk was gelabeld met een andere fluorescerende kleurstof, zodat de beweging van beide enzymen kon worden gevolgd.
Ze keken naar drie gevallen:de normale reactie waarbij hexokinase glucose fosforyleert; de reactie van hexokinase met mannose, een suiker die sterker bindt maar een langzamere reactiesnelheid heeft; en tenslotte met L-glucose, een vorm van glucose die niet door hexokinase wordt gebruikt. De fosforylering vereist ATP. In aanwezigheid van fosfoglucose-isomerase - het tweede enzym - en fosfofructokinase - het derde enzym - wordt de reactant voor aldolase geproduceerd.
De onderzoekers zagen dat de aldolase in hun flow-experiment naar de hexokinase beweegt, onthullend dat aldolase de reactantgradiënt, geproduceerd door het functioneren van de eerste drie enzymen in de route, chemotaxeerde. De chemotaxis was het grootst bij D-glucose, minder met mannose en niet waargenomen met L-glucose.
Theoretische modellering van de enzymbeweging voorspelde kwalitatief de mate van enzymbeweging.
De onderzoekers keken ook of chemotaxis van enzymen zou optreden in een model van de uitzonderlijk drukke intracellulaire omgeving. Ze voegden een stof met een groot molecuulgewicht toe om dergelijke drukte te simuleren. Chemotaxis kwam nog steeds voor, maar in een langzamer tempo.
"Chemotaxis langs een chemische gradiënt zou een factor kunnen zijn bij de assemblage van enzymclusters zoals metabolonen, " zei Benkovic. "Andere factoren, zoals niet-covalente interacties zou nog steeds worden verwacht om bij te dragen."
De resolutie van het onderzoeksinstrument, echter, was in dit geval onvoldoende om aan te tonen dat de vier enzymen zich aan het assembleren waren tot een metabolon. De onderzoekers observeerden de vorming van grote aggregaten van enzymen, maar kon niet aantonen dat het functionerende metabolons waren.
 Malaria's geheim om te overleven in het bloed ontdekt
Malaria's geheim om te overleven in het bloed ontdekt Nieuw protocol voor het meten van achtergrondniveaus van drugs in misdaadlabs
Nieuw protocol voor het meten van achtergrondniveaus van drugs in misdaadlabs Solid-ion-geleiders voor veiligere batterijen
Solid-ion-geleiders voor veiligere batterijen Zombie-scanning maakt de studie van peptide-receptor-interacties op het celoppervlak mogelijk
Zombie-scanning maakt de studie van peptide-receptor-interacties op het celoppervlak mogelijk Nieuwe techniek maakt real-time microscopie mogelijk bij hoge temperaturen en belasting
Nieuwe techniek maakt real-time microscopie mogelijk bij hoge temperaturen en belasting
 Uitbreiding van wereldwijde bossen weerspiegelt welzijn, geen stijgende CO2, deskundigen zeggen
Uitbreiding van wereldwijde bossen weerspiegelt welzijn, geen stijgende CO2, deskundigen zeggen Grondwateronderzoeken kunnen worden aangetast door vooringenomenheid van overlevenden
Grondwateronderzoeken kunnen worden aangetast door vooringenomenheid van overlevenden NASA ziet ontwikkeling van tropische storm Maha aan de zuidwestelijke kust van India
NASA ziet ontwikkeling van tropische storm Maha aan de zuidwestelijke kust van India Veerkracht opbouwen in Vieques, Puerto Rico
Veerkracht opbouwen in Vieques, Puerto Rico Echo's uit de ijstijd beïnvloeden het huidige zeeniveau
Echo's uit de ijstijd beïnvloeden het huidige zeeniveau
Hoofdlijnen
- Een verklaring van het skeletsysteem
- Hoe een 3D-model van een plantencel te maken
- De illegale schildpaddenhandel - waarom wetenschappers geheimen bewaren
- Waarom zijn chromosomen belangrijk voor celdeling?
- Zelfgemaakt skeletmodel
- Uit welke elementen bestaat glucose?
- Big data helpt onderzoekers in de strijd om plantenindringers onder controle te krijgen
- Amylase Activity in the Stomach
- Maken regenachtige dagen je echt down?
 Astronomen bestuderen eigenaardige kinematica van populaties van meerdere sterren in Messier 80
Astronomen bestuderen eigenaardige kinematica van populaties van meerdere sterren in Messier 80 Vertraagde radioflitsen door een getijdenverstoring
Vertraagde radioflitsen door een getijdenverstoring NASA-NOAA-satelliet toont omvang van Irmas-restanten
NASA-NOAA-satelliet toont omvang van Irmas-restanten Een nieuwe benadering van zeer efficiënte, luchtstabiele perovskiet zonnecellen
Een nieuwe benadering van zeer efficiënte, luchtstabiele perovskiet zonnecellen Telefoon- en autobatterijen kunnen silicium uit rijst gebruiken
Telefoon- en autobatterijen kunnen silicium uit rijst gebruiken Hoe NASA-ingenieurs rouwen om de dood van een ruimtevaartuig
Hoe NASA-ingenieurs rouwen om de dood van een ruimtevaartuig Storm brengt apocalyptische luchten naar Groot-Brittannië
Storm brengt apocalyptische luchten naar Groot-Brittannië De ontdekking van fotonen is een grote stap in de richting van grootschalige kwantumtechnologieën
De ontdekking van fotonen is een grote stap in de richting van grootschalige kwantumtechnologieën
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com






