
Wetenschap
Volatiliteitsverrassingen ontstaan bij het verwijderen van overtollig waterstof
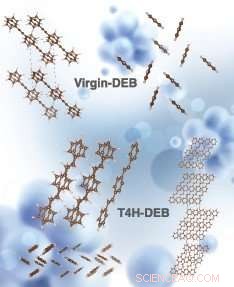
Gesimuleerde kristalstructuren van virgin-DEB en T4H-DEB (chemisch bekend als 1, 4-distyrylbenzeen, een trans-isomeer van DEB-tussenproduct na de vangst van eerste 4 atomaire waterstof met 2 CH-bindingen aan weerszijden van de koolstofketen). De structuren linksboven en rechtsboven komen overeen met zijaanzicht en bovenaanzicht van maagdelijk DEB, respectievelijk. Het midden rechts, structuren rechtsonder en linksonder komen overeen met zijaanzicht, bovenaanzicht en een eenheidscel (zijaanzicht) van T4H-DEB, respectievelijk. Credit:De simulatie is uitgevoerd door Hom Sharma. Artistieke weergave van het beeld werd gedaan door Alexandria Holmberg Diaz, Lawrence Livermore National Laboratory.
Overtollige waterstof kan problemen veroorzaken in verschillende industrieën. Het kan halfgeleiders aantasten, elektronica, en nucleaire brandstof in opslag. Het vormt ook een explosiegevaar. Om deze extra waterstof te verwijderen, scheikundigen kunnen een organische verbinding gebruiken die een waterstofvanger wordt genoemd en die chemisch bindt aan verschillende waterstofatomen.
Maar soms, tijdens dit bindingsproces - katalytische hydrogenering genoemd - worden de gedeeltelijk gehydrogeneerde producten vluchtig, smelten en verdampen voordat ze aan meer waterstofatomen kunnen binden. Nutsvoorzieningen, onderzoekers hebben onderzocht hoe en waarom deze vluchtigheid varieert tijdens hydrogenering, wat suggereert dat een voorheen ondergewaardeerd effect van koolstof-waterstofbindingen in het molecuul de belangrijkste boosdoener is.
De nieuwe analyse, gepubliceerd in The Tijdschrift voor Chemische Fysica , kan scheikundigen helpen bij het identificeren van de ideale omstandigheden die nodig zijn voor katalytische hydrogenering, zodat ze overtollige waterstof beter kunnen verwijderen.
"Hierdoor ontstaat een model voor het gedrag van andere organische getters, waardoor we hun optimale bedrijfstemperaturen en omgevingen kunnen voorspellen, " zei Lange Dinh, een natuurkundige aan het Lawrence Livermore National Laboratory.
Dinh en zijn collega's concentreerden zich op een getter genaamd 1, 4 bis(fenylethynyl)benzeen, of DEB. Om waterstof te verwijderen, kristalvlokken van DEB worden gemengd met katalysatoren in de vorm van vaste korrels. De pellets zijn gemaakt van actieve kool - waarvan de poreuze structuur een overvloedig oppervlak biedt - bedekt met palladium-nanodeeltjes. De palladiumkatalysator splitst waterstofmoleculen in waterstofatomen, die vervolgens aan DEB kunnen binden en koolstof-waterstofbindingen kunnen vormen.
DEB is een getter met hoge capaciteit, kan binden met maximaal acht waterstofatomen. De meeste onderzoekers dachten dat als getters zoals DEB met meer waterstofatomen binden en groter worden, ze worden vluchtiger. Bij hoge bedrijfstemperaturen, ze kunnen dan verdampen, ver afdrijven van de katalytische pellets waar geen waterstofatomen zijn om mee te binden. "Je stopt het hydrogeneringsproces voortijdig, ' zei Dinh.
Maar de onderzoekers ontdekten dat in de eerste twee stappen van hydrogenering, wanneer DEB twee koolstof-waterstofbindingen per stap vormt (de koolstof-waterstofbindingen worden gecreëerd aan weerszijden van de koolstofketen van het molecuul), het molecuul neemt in feite af in vluchtigheid. Alleen in de daaropvolgende hydrogeneringsstappen wordt DEB vluchtiger.
Om te bestuderen hoe en waarom DEB verandert in volatiliteit, de onderzoekers maten eigenschappen zoals dampdrukken en smeltpunten, onderzochte moleculaire structuur, en voerde kwantummechanische computersimulaties uit om het hydrogeneringsproces te modelleren. Hun analyse suggereert dat de koolstof-waterstofbindingen in DEB een sleutelrol spelen in het vluchtige gedrag van het molecuul.
Tijdens hydrogenering, waterstof bindt aan koolstofatomen in DEB. Volgens de conventionele gedachte, de resulterende koolstof-waterstofbinding is niet-polair - geen van beide uiteinden van de barbell-structuur is meer negatief of positief geladen dan de andere. Maar het blijkt dat het koolstofuiteinde iets negatiever is, en de koolstof-waterstofbinding vormt een zwakke dipool, Dinh uitgelegd.
Als dipool, een koolstof-waterstofbinding kan andere koolstof-waterstofbindingen in andere DEB-moleculen aantrekken of afstoten. Afhankelijk van hoe de koolstof-waterstofbindingen zijn gerangschikt en hoeveel er in de tussenliggende DEB-producten zijn, de moleculen kunnen elkaar aantrekken of afstoten, en dus minder of meer volatiel zijn, respectievelijk. Eerder onderzoek had deze collectieve interacties tussen koolstof-waterstofbindingen in organische kristallen over het hoofd gezien, zei Dinh.
Uit hun analyse blijkt de onderzoekers hebben vastgesteld dat de optimale omstandigheden voor DEB-hydrogenering lager zijn dan ongeveer 175 graden Fahrenheit, indien gedaan in een goed vacuüm. "Onze resultaten, "Dinh zei, "kan ook analoog worden toegepast op andere katalytische organische waterstofvangersystemen."
 Nieuwe methodologie verhoogt de resolutie in proteomics van oligodendrocyten
Nieuwe methodologie verhoogt de resolutie in proteomics van oligodendrocyten Wetenschappers stellen een nieuwe technologie voor voor het maken van microstructuren van magneten
Wetenschappers stellen een nieuwe technologie voor voor het maken van microstructuren van magneten Drie soorten warmteoverdrachten
Drie soorten warmteoverdrachten
Warmteoverdracht neemt een veld in beslag dat een breed scala aan functies omvat, van de eenvoudige processen van objecten verwarmen en koelen tot geavanceerde thermodynamische concepten in de thermische fysica. Om t
 Teamwerk in een molecuul
Teamwerk in een molecuul Typen lijm gebruikt in OSB
Typen lijm gebruikt in OSB
 Waarom kan niet al het plastic afval gerecycled worden?
Waarom kan niet al het plastic afval gerecycled worden? Oceaanatmosfeer vol met microben
Oceaanatmosfeer vol met microben Hydrologische omgeving beïnvloedt de koolstofinput van strooisel in de organische koolstofpool in de uiterwaarden van het Dongting-meer
Hydrologische omgeving beïnvloedt de koolstofinput van strooisel in de organische koolstofpool in de uiterwaarden van het Dongting-meer Droogte van de eeuw in de Middeleeuwen - met parallellen met de klimaatverandering vandaag?
Droogte van de eeuw in de Middeleeuwen - met parallellen met de klimaatverandering vandaag? Blootstelling aan verontreinigingen bij kinderen verschilt per land en verbinding
Blootstelling aan verontreinigingen bij kinderen verschilt per land en verbinding
Hoofdlijnen
- Wat zijn de functies van co-enzymen?
- Ingewikkelde ijsgrotten in Antarctica May Harbor Unique Life
- Kun je verslaafd zijn aan endorfine?
- Lijst van de toepassingen van elektroforese
- Japanse wetenschappers kweken medicijnen in kippeneieren
- Wetenschappers rapporteren chemische basis van de celdelingstimer, een mogelijk doelwit tegen kanker
- Wat is Meiotic Interphase?
- Kun je iemand echt doodsbang maken?
- Onderzoek wijst uit dat gezinsvriendelijke viaducten nodig zijn om grizzlyberen te helpen
- Onderzoekers lossen 60 jaar oude puzzel op over superhard materiaal
- Wanneer menselijke expertise het werk van machines verbetert

- Macromoleculaire kristallografie werpt licht op een nieuwe manier om de malariaparasiet aan te pakken

- Een op batterijen geïnspireerde strategie voor koolstoffixatie
- Hoe valentie van elektronen in het periodiek systeem te berekenen

 EU-bossen kunnen klimaatbestrijding niet helpen:studie
EU-bossen kunnen klimaatbestrijding niet helpen:studie Lithium-ionbatterijen naar een hoger prestatieniveau tillen
Lithium-ionbatterijen naar een hoger prestatieniveau tillen Een Quintile
Een Quintile Hoe een vlinder uit Cocoon te helpen
Hoe een vlinder uit Cocoon te helpen Bioloog betwist conclusies van recente artikelen over biologisch magnetisme
Bioloog betwist conclusies van recente artikelen over biologisch magnetisme Nieuwe aanpak kan de voorspelling van zware stormen helpen verbeteren
Nieuwe aanpak kan de voorspelling van zware stormen helpen verbeteren Uniek digitaal archief van de Egyptische revolutie van 2011 nu online
Uniek digitaal archief van de Egyptische revolutie van 2011 nu online Agroforestry kan het VK helpen de verplichtingen inzake klimaatverandering na te komen zonder de veestapel te verminderen
Agroforestry kan het VK helpen de verplichtingen inzake klimaatverandering na te komen zonder de veestapel te verminderen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

