
Wetenschap
Onderzoekers vouwen een eiwit in een eiwit
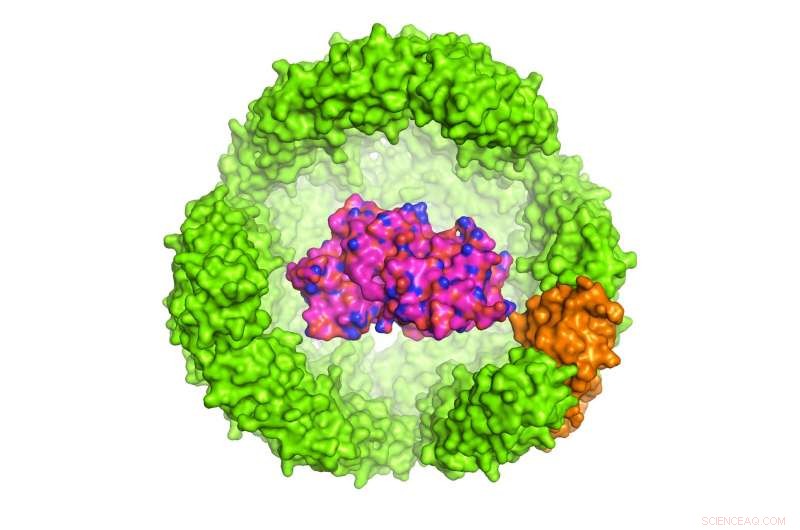
Illustratie van een interessant eiwit (POI) in een exoshell van Archeoglobus fulgidus ferritine met 24 subeenheden, die 12 nanometer in diameter is (slechts de helft van de schaal wordt getoond). Krediet:Dr. Chester L. Drum
Een team van de NUS Yong Loo Lin School of Medicine (NUS Medicine) heeft een fundamenteel nieuwe manier bedacht om recombinante eiwitten te vouwen en te beschermen. Afkomstig uit het snel groeiende veld van synthetische biologie, deze eiwit-in-een-eiwit-technologie kan de functionele eiwitopbrengst 100-voudig verbeteren en recombinante eiwitten beschermen tegen hitte, agressieve chemicaliën en proteolyse.
De expressie en stabilisatie van recombinante eiwitten is de hoeksteen van de biologische en farmaceutische industrie. De kosten en complexiteit die gepaard gaan met het vervaardigen van moeilijk te vouwen recombinante eiwitten op industriële schaal zijn een significante beperkende factor voor hun gebruik in klinische en industriële toepassingen.
De studie onder leiding van Dr. Chester Drum, Universitair Docent bij de departementen Geneeskunde en Biochemie, NUS Medicine werd gepubliceerd in het tijdschrift Natuurcommunicatie op 13 november 2017. Dr. Drum en collega's ontwierpen een exoshell met een diameter van 12 nanometer en wikkelden deze om een interessant eiwit (POI). Ze toonden voor het eerst aan dat deze technologie kan worden gebruikt om een verscheidenheid aan eiwitten te vouwen en te beschermen in kunstmatige holtes die kleiner zijn dan 1:10, 000 de breedte van een mensenhaar.
De onderzoekers ontwikkelden deze eiwit-in-een-eiwit-technologie met behulp van Archeoglobus fulgidus, een winterharde bacterie die van nature voorkomt in hydrothermale ventilatieopeningen. Deze hyperthermofiele bacteriën hebben unieke oplossingen ontwikkeld voor het vouwen en stabiliseren van eiwitten vanwege de extreme omgevingen waarin ze leven.
Vooral, maakten de onderzoekers gebruik van een ijzerhoudende, 24-subeenheid eiwit in A. fulgidus genaamd ferritine, waarvan de natuurlijke functie is om ijzer in het bloed op te slaan en te vervoeren. Ferritine van A. fulgidus heeft twee unieke eigenschappen:ten eerste, vier kleine poriën in de schaal geven kleine moleculen toegang tot de holte; tweede, in tegenstelling tot humaan ferritine, dat stabiel is bij lage zoutconcentraties, de gemanipuleerde A. fulgidus ferritine dissocieert bij lage zoutconcentraties, waardoor de inhoud van de holte kan worden vrijgegeven door een eenvoudige pH-omschakeling van 8,0 naar 5,8. Eenmaal gedissocieerd, de POI kan enzymatisch worden vrijgegeven.
Om de brede veelzijdigheid van hun technologie te demonstreren, de onderzoekers testten hun exoshell-technologie door een van de 24 ferritine-subeenheden rond drie POI's met verschillende eigenschappen te fuseren:groen fluorescerend eiwit, mierikswortelperoxidase (HRP) en Renilla-luciferase.
De exoshell hielp niet alleen de opbrengsten van alle drie de POI's te verhogen, de onderzoekers waren ook in staat om cofactoren heem en calcium te leveren, naast oxiderende omstandigheden, om ervoor te zorgen dat complexe POI's zoals HRP-eiwit kunnen vouwen en goed kunnen functioneren.
Naast het helpen om de POI's correct te vouwen, de exoshells waren ook beschermend tegen een breed scala aan denaturatiemiddelen, inclusief trypsine met een hoge concentratie; organische oplosmiddelen zoals acetonitril en methanol; en denaturatiemiddelen zoals ureum, guanidine zoutzuur, en warmte.
"We veronderstellen dat de significante toename van de functionele eiwitopbrengst te wijten kan zijn aan de complementatie tussen de negatief geladen eiwitten en het positief geladen interne oppervlak van de exoshell. Onze bevindingen benadrukken het potentieel van het gebruik van hoogtechnologische schelpen van nanometerformaat als een hulpmiddel voor synthetische biologie om drastisch invloed hebben op de productie en stabiliteit van recombinante eiwitten, " zei dokter Drum, die ook consultant cardioloog is bij het National University Hospital en directeur van het Clinical Trial Innovation Lab bij TLGM, EEN STER.
Aangeworven aan de Nationale Universiteit van Singapore in 2011, hij heeft sindsdien financiering ontvangen van de Singapore MIT Alliance for Research and Technology, Nationale Medische Onderzoeksraad, Biomedische Onderzoeksraad, A*STAR en NUS Geneeskunde.
Het huidige onderzoek van Dr. Drum overbrugt de kloof tussen basale biochemie en klinische zorg. Hij is momenteel de hoofdonderzoeker van een multi-institutionele, 3, Observatieonderzoek van 000 personen in Singapore waarin wordt onderzocht hoe gepersonaliseerd medicijnmetabolisme de respons op geneesmiddelen beïnvloedt.
 Menselijke activiteiten die het ecosysteem beïnvloeden
Menselijke activiteiten die het ecosysteem beïnvloeden  Typen Snapping Turtles
Typen Snapping Turtles Rapport biedt kader om beslissingen te begeleiden over Spirit Lake en Toutle River op Mount St. Helens
Rapport biedt kader om beslissingen te begeleiden over Spirit Lake en Toutle River op Mount St. Helens 10 geweldige groene steden
10 geweldige groene steden  Studie toont erosie van ozonlaag aan die verantwoordelijk is voor massale uitstervingsgebeurtenis
Studie toont erosie van ozonlaag aan die verantwoordelijk is voor massale uitstervingsgebeurtenis
Hoofdlijnen
- 85 nieuwe soorten beschreven door de California Academy of Sciences in 2017
- Otzi the Iceman at een vetrijke laatste maaltijd
- Hoe een tRNA-reeks te krijgen van een DNA-reeks
- Studie onderzoekt de effecten van insecticiden op honingbijen
- De wereldwijde impact van krimpende gletsjers op ongewervelde rivieren in kaart brengen
- Studie van gierende kraanvogels onthult een band tussen paren zelfs voordat ze de paringsleeftijd hebben bereikt
- Investeren in natuurbehoud loont, studie vondsten
- Onderzoek toont aan dat plantengroeiregulatoren gunstig kunnen zijn voor de vestiging van uien, productie
- Wat is de laatste gemeenschappelijke voorouder?
- Welke rol speelt warmte bij chemische reacties?

- De strijd tegen tandbederf krijgt hulp met een nieuw slim materiaal

- Zonnewaterstof:fotoanodes beloven hoge efficiëntie
- Nieuwe legering om loodprobleem in drinkwater op te lossen

- Verlaging van de bedrijfstemperatuur van keramische brandstofcellen met een elektrolyt met hoge protongeleiding
 Het ijsverlies op Groenland is mogelijk al in het midden van de jaren 80 begonnen
Het ijsverlies op Groenland is mogelijk al in het midden van de jaren 80 begonnen Verizon voegt meer mobiele telefoonklanten toe; winstbewijzen
Verizon voegt meer mobiele telefoonklanten toe; winstbewijzen Verschuivende kustlijnen bij Lake Tahoe veroorzaakt door oude lavadammen
Verschuivende kustlijnen bij Lake Tahoe veroorzaakt door oude lavadammen Het klimaat in het Jura-tijdperk
Het klimaat in het Jura-tijdperk Negen jaar later, staat van de sanering in de kerncentrale van Fukushima
Negen jaar later, staat van de sanering in de kerncentrale van Fukushima Bewijs van buitenaardse wezens? Wat te denken van onderzoek en rapportage over Oumuamua, onze bezoeker vanuit de ruimte
Bewijs van buitenaardse wezens? Wat te denken van onderzoek en rapportage over Oumuamua, onze bezoeker vanuit de ruimte Fossiele kevers suggereren dat het klimaat in LA al 50 jaar relatief stabiel is, 000 jaar
Fossiele kevers suggereren dat het klimaat in LA al 50 jaar relatief stabiel is, 000 jaar Computerwetenschappers ontwerpen een manier om achterdeuren in op AI gebaseerde beveiligingssystemen te sluiten
Computerwetenschappers ontwerpen een manier om achterdeuren in op AI gebaseerde beveiligingssystemen te sluiten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

