
Wetenschap
Onderzoekers onderzoeken hersenziekte-veroorzakende eiwitten op atomair niveau
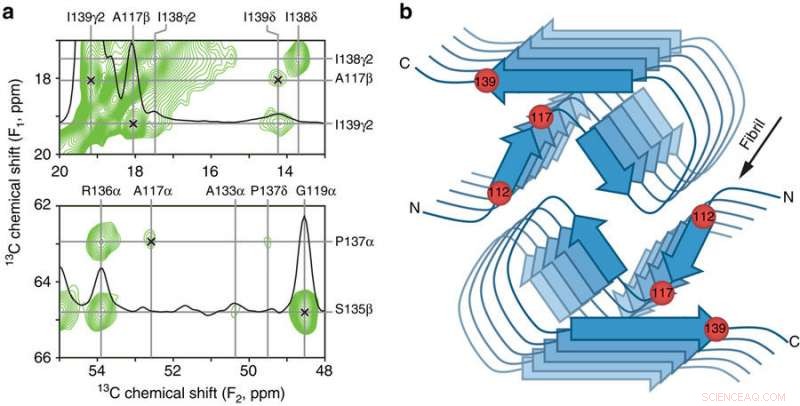
Belangrijke interresiducontacten en schematisch model van de menselijke PrP23-144 amyloïde β-kern. a Kleine regio's van een 900 MHz tweedimensionaal 13C-13C DARR solid-state NMR-spectrum opgenomen met een mengtijd van 500 ms voor amyloïde fibrillen gegenereerd uit huPrP23-144 uitgedrukt met 3-13C-pyruvaat als de koolstofbron. De spectrale gebieden bevatten de belangrijkste beperkingen op de [hu] amyloïde kernstructuur in de vorm van ondubbelzinnige lange-afstandscorrelaties (aangegeven door x-markeringen) tussen de volgende 13C-atomen:A117Cβ-I139Cγ2, A117Cβ-I139Cδ, A117Cα-P137Cα, en G119Cα-S135Cβ. b Schematisch model voor de [hu] amyloïde kern op basis van de combinatie van solid-state NMR en gekantelde bundel transmissie-elektronenmicroscopiegegevens (zie tekst voor details). In dit model bestaan [hu] amyloïde fibrillen uit twee protofilamenten in een C2-symmetrische opstelling met β-sheetgebieden die parallel lopen aan de lange fibrilas. De geschatte locaties van aminozuurresiduen 112, 117, en 139, die een grote impact hebben op de structuur die wordt aangenomen door PrP23-144 amyloïde zoals besproken in de tekst, zijn aangegeven met rode bollen. Credit: Natuurcommunicatie (2017). DOI:10.1038/s41467-017-00794-z
Onderzoekers die een eiwit bestuderen dat een erfelijke degeneratieve hersenziekte bij mensen veroorzaakt, hebben ontdekt dat de mens, muis- en hamstervormen van het eiwit, die bijna identieke aminozuursequenties hebben, vertonen verschillende driedimensionale structuren op atomair niveau.
Het eiwit veroorzaakt familiale humane cerebrale amyloïde angiopathie (CAA), en de studie, die verschijnt in Natuurcommunicatie , is de eerste die vormen van het eiwit in drie verschillende soorten onderzocht.
Christoffel Jaroniec, hoogleraar scheikunde en biochemie aan de Ohio State University, zei dat de bevindingen het feit benadrukken dat kleine veranderingen in afzonderlijke aminozuren diepgaande verschillen in structuur en functie tussen deze familie van eiwitten kunnen veroorzaken.
"De grootschalige verschillen in de structuren en transmissiekenmerken van deze eiwitten - veroorzaakt door schijnbaar onbeduidende verschillen in de posities van enkele koolstof- en waterstofatomen - zijn behoorlijk opmerkelijk, ' zei Jaroniec.
De studie vormt geen basis voor een nieuwe test of behandeling voor CAA, maar gebruikt deze eiwitten eerder als modellen voor het begrijpen van de fundamentele aspecten van de overdracht tussen soorten van een hele klasse van degeneratieve hersenziekten die bekend staan als prionziekten, hij legde uit. Het onderstreept ook het nut van solid-state nucleaire magnetische resonantie (NMR) spectroscopie voor het afbeelden van de structuren van eiwitten die geassocieerd zijn met prionziekten.
Onderzoekers weten dat in het lichaam, de eiwitmoleculen geassocieerd met CAA vormen plaques die zich nestelen in de bloedvatwanden in de hersenen, maar tot voor kort waren er geen gedetailleerde onderzoeken van de moleculaire structuur van deze plaques. In 2008, Onderzoekers van de staat Ohio en hun partners van Case Western Reserve University voerden de eerste solid-state studies uit van de relevante prion-eiwitvariant, en vernauwde de lijst van mogelijk kritische aminozuren voor zijn functie tot ongeveer 30.
Nutsvoorzieningen, ze hebben aangetoond dat een enkel aminozuur - bekend door zijn nummer langs de eiwitketen, 139 - is de sleutel tot deze prion-eiwitvariant die een "mensachtige" versus een "hamsterachtige" structuur aanneemt, terwijl een ander aminozuur, 112, regelt de structurele verschillen tussen de menselijke en muisversies van het eiwit. Ze hebben ook aangetoond dat deze twee aminozuren verantwoordelijk lijken te zijn voor het ontstaan van structureel verschillende "prionstammen" binnen dezelfde eiwitsequentie, analoog aan verschillende stammen van een virus.
De meest bekende prionziekten zijn boviene spongiforme encefalopathie (vaak "gekkekoeienziekte" genoemd) en de ziekte van Creutzfeldt-Jakob bij mensen. Allen zijn ongeneeslijk en dodelijk, en sommige kunnen ook overdraagbaar zijn. Men denkt dat de structuren die door de prioneiwitten van de hersenen in de plaques worden geadopteerd, van cruciaal belang zijn voor hun vermogen om tussen verschillende gastheren te worden overgedragen en ziekte te veroorzaken.
"Onze groep werkt momenteel aan het bepalen van de moleculaire structuren met hoge resolutie van de afgeknotte prion-eiwitvarianten die geassocieerd zijn met familiaal menselijk CAA om een volledig atomistisch begrip te krijgen van de factoren die ten grondslag liggen aan hun overdracht, en de huidige studie is een belangrijke opstap in deze inspanning, ' zei Jaroniec.
"We hopen dat onze groep en andere onderzoekers op een dag soortgelijke methoden zullen kunnen gebruiken om de structurele basis van de overdraagbare prionziekten te ontrafelen, " hij voegde toe.
 MOF-gegevensset biedt 10, 000 structuren gratis voor academisch onderzoek
MOF-gegevensset biedt 10, 000 structuren gratis voor academisch onderzoek Video:Betere pannenkoeken door chemie
Video:Betere pannenkoeken door chemie Onderzoekers ontwikkelen de eerste functionele niet-eigen metaalhydrogenase
Onderzoekers ontwikkelen de eerste functionele niet-eigen metaalhydrogenase Geuren langer laten duren
Geuren langer laten duren Doorbraak bereikt bij het verbeteren van de ionische geleidbaarheid van brandstofcelmaterialen
Doorbraak bereikt bij het verbeteren van de ionische geleidbaarheid van brandstofcelmaterialen
Hoofdlijnen
- 6 veelvoorkomende hallucinaties en wat ze ons vertellen
- Fysieke aanpassingen van rondwormen
- DropSynth, een eenpotsbenadering van gensynthese
- Een 3D-poster maken van de celcyclus
- Ontdekt? Nieuw maar uitgestorven menselijk familielid uit Melanesië
- Wetenschappers roepen op tot actie om de dreiging van invasieve boomsoorten voor een wereldwijde hotspot voor biodiversiteit aan te pakken
- Twee van 's werelds theesoorten uitgestorven in het wild volgens nieuw rapport
- Welke moleculen kunnen er zonder hulp door het plasmamembraan passeren?
- Hoe bekritiseer je iets zonder een eikel te zijn?
- COVID-19 stelt nieuwe wetenschap op de proef
- Activering van koolstof-fluorbindingen door samenwerking van een fotokatalysator en tin

- Zelfherstellend omgekeerd filter opent de deur voor veel nieuwe toepassingen

- Nieuw composiet bevordert lignine als een hernieuwbaar 3D-printmateriaal

- Nieuw bewijsmateriaal ingediend bij Grenfell Tower Inquiry over bekledingsreactiviteit

 Berlijns punkrockdistrict vervolgt strijd tegen Google
Berlijns punkrockdistrict vervolgt strijd tegen Google Netflix en YouTube verlagen resolutie als virus op internet komt
Netflix en YouTube verlagen resolutie als virus op internet komt Stralingslekken bij plutoniumlab in Japan, geen werknemers blootgesteld
Stralingslekken bij plutoniumlab in Japan, geen werknemers blootgesteld Hete nanostructuren koelen sneller af als ze fysiek dicht bij elkaar staan
Hete nanostructuren koelen sneller af als ze fysiek dicht bij elkaar staan Gemodificeerde sojabonen leveren meer op in toekomstige klimaatomstandigheden
Gemodificeerde sojabonen leveren meer op in toekomstige klimaatomstandigheden RES URBIS-project toont de levensvatbaarheid van de productie van bioplastic met stedelijk bioafval
RES URBIS-project toont de levensvatbaarheid van de productie van bioplastic met stedelijk bioafval Waarschuwingsstatus vulkanen Bali verlaagd na verminderde activiteit
Waarschuwingsstatus vulkanen Bali verlaagd na verminderde activiteit Hoe een wetenschapsbeurs te ontwerpen Poster
Hoe een wetenschapsbeurs te ontwerpen Poster
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

