Wetenschap
Monkey-moersleutelmolecuul blokkeert tuberculose-eiwit
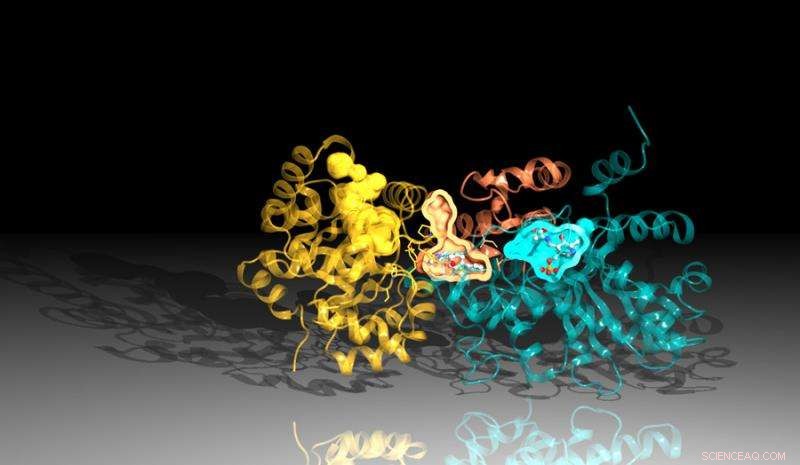
Afbeelding van het eiwit tryptofaansynthase gemaakt met behulp van diffractiegegevens van Argonne's Advanced Photon Source. De remmer bindt tussen de reactieplaatsen in het eiwit, hier weergegeven door de oranje en blauwe zakken. Krediet:Argonne National Laboratory
Tuberculose heeft HIV nu wereldwijd overtroffen als de belangrijkste doodsoorzaak als gevolg van infectieziekten. De bacteriën die deze ziekte veroorzaken, Mycobacterium tuberculosis (Mtb), ontwikkelt snel resistentie tegen de momenteel beschikbare antibiotica, het vergroten van de urgentie voor het ontdekken van nieuwe medicijnen.
Wetenschappers van het Argonne National Laboratory van het Amerikaanse Department of Energy (DOE) maakten deel uit van een recente ontdekking van een nieuwe molecule, een remmer genaamd, die tuberculose-veroorzakende bacteriën aanvalt door de productie van een chemische stof af te snijden die nodig is voor hun overleving.
Het maken van antibiotica omvat het ontwikkelen van remmers die essentiële bacteriële processen effectief kunnen blokkeren. Even belangrijk is het blijven vinden van nieuwe wegen om zich te richten, zodat wanneer de bacteriën zich uiteindelijk aanpassen om één antibioticum te weerstaan, er zijn nog andere mogelijkheden om te exploiteren.
De nieuwe studie, een samenwerking tussen Argonne, de Universiteit van Chicago en het Broad Institute of Harvard en MIT, identificeerde een remmer die werkt door de werking van een belangrijk eiwit in Mtb te blokkeren. De remmer bindt aan een kanaal in het eiwit dat de twee delen verbindt, het doden van de bacteriën door een ironische draai. De remmer dwingt een deel van het eiwit om de componenten te produceren die nodig zijn om een essentiële chemische stof te maken, tryptofaan, terwijl het tegelijkertijd het kanaal hervormt om die ingrediënten te onderscheppen voordat het andere deel van het eiwit ze kan gebruiken.
Dit soort remmers, allosterische remmers genoemd, binden niet aan het deel van het eiwit dat daadwerkelijk verantwoordelijk is voor de productie van de beoogde chemische stof. In plaats daarvan, ze fungeren als een aapsleutel die vastzit in andere, minder voor de hand liggende delen van de gecompliceerde machinerie van de bacteriën. De in dit onderzoek geïdentificeerde remmer, beschreven in een recent artikel in Nature Chemical Biology, is nu een van de meest bestudeerde allosterische remmers tot nu toe.
De gerichte chemische, tryptofaan, is een stof die cruciaal is om alle levende cellen hun structuur te geven en ze te beschermen tegen hun omgeving. Menselijke cellen moeten tryptofaan uit voedsel of bacteriën in de darm snuffelen, maar Mtb-cellen kunnen hun eigen tryptofaan produceren met behulp van een complex eiwit dat tryptofaansynthase wordt genoemd. "We wisten dat een manier om deze bacteriën te doden een manier was om de tryptofaansynthase te blokkeren, " zei Karolina Michalska, een Argonne-kristallograaf en auteur van de studie.
Voordat de samenwerking begon, een groep wetenschappers van het Broad Institute stopte een kleine hoeveelheid van de bacteriën in petrischalen en plaatste er verschillende potentiële remmers in. Uit een bibliotheek van meer dan 80, 000 geteste potentiële remmers, slechts enkelen hebben de Mtb gedood. De wetenschappers vermoedden dat een van deze remmers de tryptofaansynthase van de Mtb uitschakelde, maar ze moesten zien wat er op moleculair niveau gebeurde.
Wetenschappers van Argonne hoorden over het werk aan het Broad Institute, en de twee groepen begonnen samen te werken. Argonne produceerde tryptofaansynthase voor het Broad Institute om te gebruiken voor het testen van de remmer. Ze bepaalden ook de structuur van het synthase met de remmer eraan gebonden door kristallen bestaande uit het eiwit-remmercomplex bloot te stellen aan hoogenergetische röntgenstralen van Argonne's Advanced Photon Source (APS) en vast te leggen hoe de elektronen in het molecuul het licht verstrooiden .
"De samenwerking maakte het voor ons mogelijk om de allosterische aard van de remmer te bepalen en de nuances van hoe de remming werkte, " zei Deborah Hung, een professor aan de Harvard Medical School en mededirecteur van het Infectious Disease and Microbiome Program aan het Broad Institute.
De structurele analyse stelde vast dat er twee belangrijke onderdelen zijn waaruit tryptofaansynthase bestaat. Wanneer een van de regio's aan de andere aangeeft dat het klaar is, de andere regio maakt een chemische stof die indool wordt genoemd. Het indool reist dan door een kanaal naar het andere gebied van het tryptofaansynthase waar het zich combineert met een andere stof om het eindproduct te creëren, tryptofaan.
Een lichte instabiliteit in het kanaal zou het indool mogelijk maken om naar de andere kant te reizen, maar de remmer is zo gevormd dat het het kanaal stabiliseert, voorkomen dat de indol beweegt. Omdat de indool de andere kant van het eiwit niet kan bereiken, de remmer blokkeert de productie van tryptofaan.
"Het werkt eigenlijk op een heel stiekeme manier, " zei Andrzej Joachimiak, Directeur van Argonne's Structural Biology Centre en het Midwest Centre for Structural Genomics. "De remmer dwingt zowel het tryptofaansynthase om de indool te produceren als te voorkomen dat het zijn ultieme taak uitvoert."
Hoewel onderzoekers optimistisch zijn over het potentieel van deze remmer als antibioticum, het is nog lang geen beschikbaar geneesmiddel. Ze hebben onderzocht hoe menselijk weefsel zou reageren op het molecuul en hebben bevestigd dat het niet-toxisch is, maar experimenten bij muizen hebben aangetoond dat de remmer te snel door het lichaam zou worden gemetaboliseerd. Er wordt nu onderzoek gedaan om de structuur van de remmer te verfijnen, zodat deze voor langere tijd in de bloedbaan blijft.
 Video:Wat is de chemie achter ringworm?
Video:Wat is de chemie achter ringworm? Bio-ingenieurs onthullen verrassende zintuiglijke en zelfgenezende vermogens van zeedieren
Bio-ingenieurs onthullen verrassende zintuiglijke en zelfgenezende vermogens van zeedieren Praktische oplossing voor het voorkomen van corrosieve opbouw in nucleaire systemen
Praktische oplossing voor het voorkomen van corrosieve opbouw in nucleaire systemen Wat is het doel van het filterpapier in het Thin-Layer Chromatography (TLC) proces?
Wat is het doel van het filterpapier in het Thin-Layer Chromatography (TLC) proces?  Eigenschappen van Nylon
Eigenschappen van Nylon
 Naties bereiken mijlpaal VN-klimaatrapport na marathonbesprekingen
Naties bereiken mijlpaal VN-klimaatrapport na marathonbesprekingen Welk deel van de aarde heeft het koudste klimaat?
Welk deel van de aarde heeft het koudste klimaat?  Nieuw, snel mechanisme voor de vorming van atmosferische deeltjes
Nieuw, snel mechanisme voor de vorming van atmosferische deeltjes Wisseling van ploegen op de noordpool
Wisseling van ploegen op de noordpool Hogesnelheidstrein aan de oostkust van Australië zou de uitstoot tot 36 jaar verhogen
Hogesnelheidstrein aan de oostkust van Australië zou de uitstoot tot 36 jaar verhogen
Hoofdlijnen
- De isovormen van het HP1-eiwit reguleren de organisatie en structuur van heterochromatine
- Wat zijn de verschillen tussen een centraal zenuwstelsel en een centraal zenuwstelsel?
- Projectideeën voor biotechnologie
- Radiometrische datering: definitie, hoe werkt het, gebruik & voorbeelden
- Het herprogrammeren van bacteriën in plaats van ze te doden kan het antwoord zijn op antibioticaresistentie
- 3 soorten mutaties die kunnen optreden in het DNA Molecuul
- Biotechnologie en genetische manipulatie: een overzicht
- Music Science Fair Project Ideas
- Hoe stadia van mitose in een cel onder een microscoop te identificeren
 Meteoor waarschijnlijk oorzaak van felle flits in de nachtelijke hemel van Florida
Meteoor waarschijnlijk oorzaak van felle flits in de nachtelijke hemel van Florida Panzerkampfwagen VI Tiger II
Panzerkampfwagen VI Tiger II  Wetenschappers stellen verbeteringen voor aan precisie-irrigatie van gewassen
Wetenschappers stellen verbeteringen voor aan precisie-irrigatie van gewassen Mitochondria: definitie, structuur en functie (met diagram)
Mitochondria: definitie, structuur en functie (met diagram)  Het IPCC oceans-rapport is een wake-up call voor beleidsmakers
Het IPCC oceans-rapport is een wake-up call voor beleidsmakers Hoe maak je een magneet afweermetaal
Hoe maak je een magneet afweermetaal  Onbepaald of oneven-even autoproeven de luchtvervuiling in India kunnen bestrijden
Onbepaald of oneven-even autoproeven de luchtvervuiling in India kunnen bestrijden Technologie met kunstmatige intelligentie kan de watervoorziening helpen beschermen
Technologie met kunstmatige intelligentie kan de watervoorziening helpen beschermen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com