
Wetenschap
Onderzoekers vinden nieuwe manier om kankercellen aan te pakken
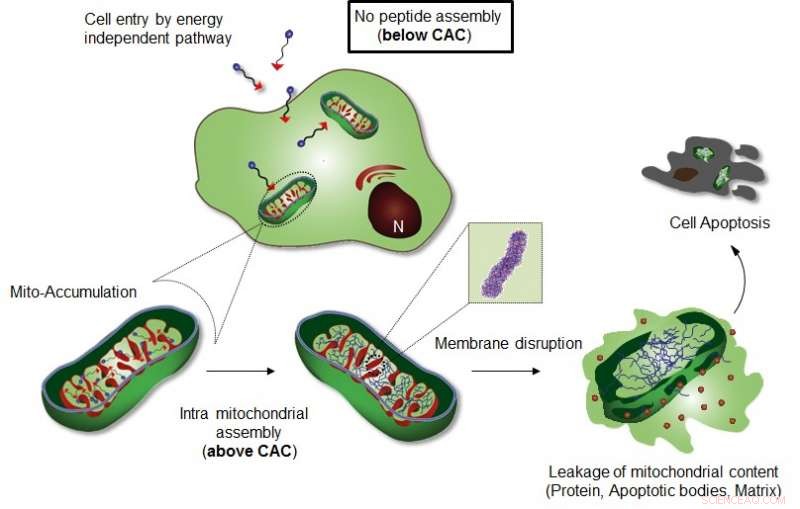
Figuur toont intra-mitochondriale assemblage van Mito-FF. Krediet:UNIST
In-situ assemblage van amfifiele peptiden met bijbehorende cellulaire functies in een levende cel (d.w.z. intracellulaire assemblage) en hun interactie met cellulaire componenten zijn naar voren gekomen als een veelzijdige strategie bij het beheersen van het cellulaire lot. Echter, het bereiken van spatiotemporele controle (d.w.z. binnen cellulaire organellen of andere subcompartimenten) over de zelfassemblage van synthetische moleculen in de cel is een uitdaging vanwege de moeilijkheid om hun gedrag in de complexe intracellulaire omgeving te bestuderen.
Een recente studie, aangesloten bij UNIST heeft een nieuwe methode ontwikkeld om de mitochondriën van een kankercel aan te pakken. Het onderzoeksteam verwacht dat hun studie de weg zou kunnen effenen voor een nieuwe generatie geneesmiddelen tegen kanker.
Dit onderzoek is geleid door professor Ja-Hyoung Ryu of Chemistry aan UNIST in samenwerking met Sang Kyu Kwak van Energy and Chemical Engineering aan UNIST en professor Eunji Lee van Graduate School of Analytical Science and Technology aan de Chungam National University. De resultaten van het onderzoek zijn verschenen in de editie van 21 april van: Natuur Communicatie.
In de studie, het gezamenlijke onderzoeksteam heeft geïntroduceerd, Voor de eerste keer, de organel-gelokaliseerde zelfassemblage van een peptide-amfifiel als een krachtige strategie voor het beheersen van het cellulaire lot.
Zelfmontage is een evenwichtsproces tussen de afzonderlijke bouweenheden en hun geaggregeerde staat, en de concentratie van de moleculen moet boven de kritische waarde liggen om assemblage te induceren (d.w.z. de kritische aggregatieconcentratie (CAC). In levende cellen, het behalen van de CAC is ook vereist om assemblages van individuele moleculen te vormen, maar heeft een beperking omdat de chemische complexiteit van cellulaire omgevingen interacties tussen synthetische bouweenheden verstoort.
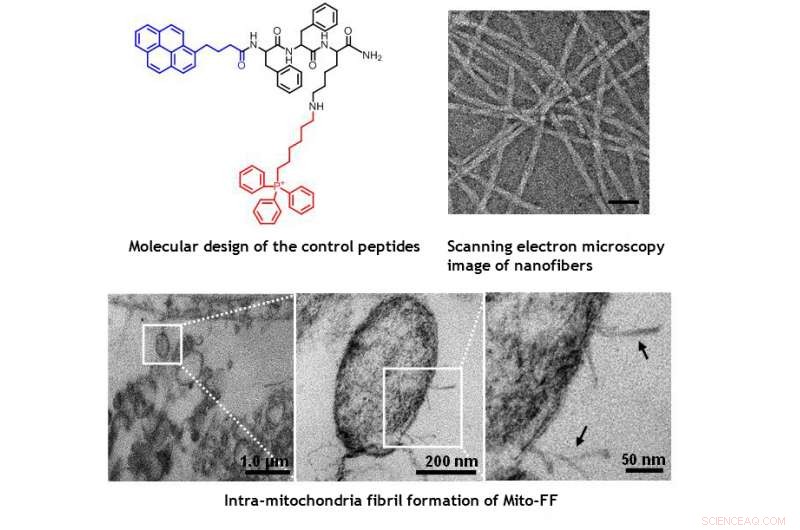
TEM-afbeeldingen van mitochondriën in de HeLa-cel die de morfologische schade laten zien die wordt veroorzaakt door Mito-FF. Krediet:UNIST
Intracellulaire zelfassemblage, dus, vereist een hogere concentratie van de moleculen dan de CAC, die de praktische implementatie van zelfassemblerende moleculen kunnen beperken. Transformatie van de moleculaire structuur van hydrofiele naar hydrofobe eenheden in de cel (of pericellulaire ruimte) door externe stimuli (chemisch, of fysiek) is een krachtige strategie om de CAC te verminderen door de neiging tot zelfassemblage te vergroten. Echter, chemische en fysieke prikkels (bijv. licht, temperatuur, pH, en redox) zijn niet relevant voor intracellulaire assemblage omdat ze ernstige celbeschadiging veroorzaken.
Het onderzoeksteam van professor Ryu introduceerde een specifiek door cellulair organel-lokalisatie geïnduceerd supramoleculaire zelfassemblage (OLISA) systeem dat een algemene strategie zou kunnen zijn om zelfassemblage te induceren door lokale concentraties van de zelfassemblerende moleculen te verhogen zonder aanvullende behandeling. De kleine moleculen diffunderen gemakkelijk door het celmembraan, reiken naar de doelplaats (organel of subcellulair compartiment, afhankelijk van de doelgroep), en dan ondergaan ze zelfassemblage in het beoogde organel als gevolg van verhoogde lokale concentratie. De opeenhoping van moleculen in een organel zoals mitochondriën is ~500-1, 000 keer hoger dan die van de extracellulaire ruimte.
"OLISA is een meer algemene en directe strategie voor het bereiken van intracellulaire assemblage en is geheel nieuw, het is een veelbelovende benadering voor het beheersen van het cellulaire lot zoals apoptose, celproliferatie enz. en is een nuttige strategie voor hun diepgaande onderzoeken", zegt professor Ryu.
Het ontwerp bestaat uit mitochondria-accumulerend amfifiel peptide (Mito-FF), die bestaat uit difenylalanine als een β-bladvormende bouwsteen, TPP als mitochondriaal gericht deel, en pyreen als een fluorescerende sonde. Mito-FF accumuleerde gunstig in de mitochondriën van kankercellen vanwege het hoge negatieve membraanpotentieel en de verhoogde concentratie zorgde ervoor dat Mito-FF zichzelf assembleerde tot een vezelachtige structuur, terwijl gebrek aan fibrilvorming werd waargenomen in normale cellen. De stijve Mito-FF-fibrillen vernietigden het mitochondriale membraan en activeerden de intrinsieke apoptotische route tegen kankercellen. Dit OLISA-systeem biedt een nieuwe aanpak voor gerichte chemotherapie bij kanker.
MT Jeena of Chemistry bij UNIST, de hoofdauteur van de studie verwacht dat de nieuwe methode de basis zal leggen voor een nieuwe reeks behandelingen die het genezingsproces kunnen maximaliseren en bijwerkingen kunnen minimaliseren.
 Out of the blue:Middeleeuwse fragmenten leveren verrassingen op
Out of the blue:Middeleeuwse fragmenten leveren verrassingen op Nieuwe doorbraak in de strijd tegen antibioticaresistentie
Nieuwe doorbraak in de strijd tegen antibioticaresistentie Laatste bevindingen over bittere stoffen in koffie
Laatste bevindingen over bittere stoffen in koffie Door grote stille genen op te heffen, kunnen bacteriën nieuwe moleculen produceren, potentiële kandidaat-geneesmiddelen
Door grote stille genen op te heffen, kunnen bacteriën nieuwe moleculen produceren, potentiële kandidaat-geneesmiddelen Superresolutiemicroscopie bouwt multicolor 3D van 2D
Superresolutiemicroscopie bouwt multicolor 3D van 2D
 Nieuwe landbedekkingsatlas onthult dat slechts 6 procent van het VK is ontwikkeld
Nieuwe landbedekkingsatlas onthult dat slechts 6 procent van het VK is ontwikkeld Orkaanseizoen in combinatie met COVID-19-pandemie kan perfecte storm veroorzaken
Orkaanseizoen in combinatie met COVID-19-pandemie kan perfecte storm veroorzaken Industriële chemicaliën gaan tijdens de zwangerschap van moeder op foetus
Industriële chemicaliën gaan tijdens de zwangerschap van moeder op foetus Oude verzwakking van de aardkorst verklaart ongebruikelijke aardbevingen in de plaat
Oude verzwakking van de aardkorst verklaart ongebruikelijke aardbevingen in de plaat Welke planten leven in de luifellaag?
Welke planten leven in de luifellaag?
Hoofdlijnen
- Hoe kunnen nieuwe cellen iemands gezichtsvermogen herstellen?
- Nieuwe database catalogiseert planten die verontreiniging opnemen
- Hoe beïnvloedt fosforylering de eiwitactiviteit?
- Inspanningen van de marine om walvissen te beschermen hebben beperkt effect
- Citroenfruit versterken om beter bestand te zijn tegen klimaatverandering
- Celsignalen die wondgenezing in gang zetten zijn verrassend complex
- Salamander-genoom geeft aanwijzingen over uniek regeneratief vermogen
- Inzicht in onze levensduur van meer dan 50 jaar die nog steeds in ontwikkeling is, genetische studie toont aan
- Geen zoetekauw meer? Wetenschap schakelt het verlangen naar suiker bij muizen uit
- Nieuwe studie identificeert mogelijke voorouders van RNA

- Metalen nanokatalysatoren imiteren de structuur van enzymen

- Een gestroomlijnde benadering voor het bepalen van thermische eigenschappen van kristallijne vaste stoffen en legeringen

- De grenzen van hematiet

- MOF's van de toekomst:kristallijne metaal-organische raamwerken omzetten in glas of vloeistof

 Spontane stofvangers:astronomen ontdekken een ontbrekende schakel in planeetvorming
Spontane stofvangers:astronomen ontdekken een ontbrekende schakel in planeetvorming Netwerken van jagers-verzamelaars versnelden de menselijke evolutie
Netwerken van jagers-verzamelaars versnelden de menselijke evolutie Ultralaag stroomverbruik voor gegevensregistratie
Ultralaag stroomverbruik voor gegevensregistratie Nieuwe brand ontsteekt in de buurt van LA terwijl felle bosbranden in Californië woeden
Nieuwe brand ontsteekt in de buurt van LA terwijl felle bosbranden in Californië woeden Nieuwe koolstofnanobuissensor kan minuscule sporen van explosieven detecteren
Nieuwe koolstofnanobuissensor kan minuscule sporen van explosieven detecteren Een eeuw volkshuisvesting:woningen bouwen, niet alleen huizen, er is meer nodig dan bakstenen en mortel
Een eeuw volkshuisvesting:woningen bouwen, niet alleen huizen, er is meer nodig dan bakstenen en mortel WTF, wanneer leren wetenschappers minder acroniemen te gebruiken?
WTF, wanneer leren wetenschappers minder acroniemen te gebruiken? Waarom willen mensen het regenwoud redden?
Waarom willen mensen het regenwoud redden?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | German | Dutch | Danish | Norway | Portuguese |

-
Wetenschap © https://nl.scienceaq.com

