Wetenschap
Onderzoek naar de relatie tussen het tweelichaam en het collectief
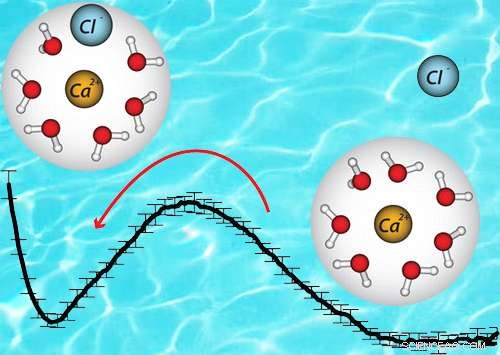
De vrije energie is verschillend tussen het ionenpaar (links) en het ion alleen (rechts). Het was niet mogelijk om dit verschil met eerdere benaderingen te zien. Krediet:American Chemical Society
Van batterijen tot biologie, zouthoudende vloeistoffen zijn essentieel voor blijvende prestaties. Het nauwkeurig begrijpen van het gedrag van deze vloeistoffen is afhankelijk van het correct weergeven van de moleculaire structuren die ze vormen. Dr. Marcel Baer, Dr. Timothy Duignan, en Dr. Christopher Mundy van het Pacific Northwest National Laboratory hebben vastgesteld dat de precieze structuur van een paar ionen geïsoleerd in water nauwkeurig aangeeft hoe een hele oplossing zich zal gedragen.
"Deze nauwkeurige lokale structuur is het belangrijkste onderdeel bij het relateren van het microscopische aan het macroscopische, of intrinsieke eigenschappen van de ionen in oplossing voor collectieve eigenschappen, " zei Mundy, die de studies leidde bij PNNL.
Door berekeningen en experimenten te integreren rond twee ionen die een ionenpaar van zout vormen, het team kan de collectieve aard van de oplossing begrijpen. Namelijk, het team kan de clusteringstatistieken begrijpen omdat deze betrekking hebben op het specifieke gedrag van de ionen bij verschillende concentraties, die wordt gemeten door de osmotische coëfficiënt. specifiek, vormt de elektrolyt in clusters of blijft het als geïsoleerde ionen bij verschillende concentraties?
Het gedrag en de soortvorming van elektrolyten beïnvloeden alles, van hun gebruik als batterijelektrolyten tot hun gedrag in complex kernafval. Door te begrijpen hoe individuele eigenschappen van ionen hun collectieve gedrag beïnvloeden, wetenschappers kunnen bepalen hoe de concentratie en het type elektrolyt kunnen worden aangepast voor specifieke toepassingen.
Het team onderzocht hoe de juiste moleculaire structuur de thermodynamica van de oplossing beïnvloedt. Ze bepaalden de structuur door middel van uitgebreide metingen van de fijne structuur van röntgenabsorptie en moleculaire simulatie op basis van de kwantummechanica. Het werk van het team laat zien dat het mogelijk is om te voorspellen in welke mate ionen in oplossing zijn gekoppeld (activiteit genoemd) door nauwkeurige beschrijvingen van het lokale ion-water te gebruiken, en ion-ion interacties.
In een gelijktijdig uitgenodigd overzichtsartikel met Dr. Tim Duignan, het team demonstreerde hoe de koppeling goed te krijgen met berekeningen op hoog niveau. De resultaten bieden de nodige moleculaire details om macroscopische theorieën over ionsolvatie te verbeteren.
 Een nieuwe kijk op brillen
Een nieuwe kijk op brillen Elk moment van ultrasnelle chemische binding vastgelegd op film
Elk moment van ultrasnelle chemische binding vastgelegd op film Cellen construeren levende composietpolymeren voor biomedische toepassingen
Cellen construeren levende composietpolymeren voor biomedische toepassingen NIST beschrijft plannen voor het herzien van de wetenschappelijke grondslagen van forensische methoden
NIST beschrijft plannen voor het herzien van de wetenschappelijke grondslagen van forensische methoden Hoe beïnvloedt de temperatuur de activiteit van Catalase-enzym?
Hoe beïnvloedt de temperatuur de activiteit van Catalase-enzym?
 Rechtbank beveelt verbod op schadelijke pesticiden, zegt dat EPA de wet heeft overtreden
Rechtbank beveelt verbod op schadelijke pesticiden, zegt dat EPA de wet heeft overtreden Hoe te bepalen of een hoofdvogel mannelijk of vrouwelijk is
Hoe te bepalen of een hoofdvogel mannelijk of vrouwelijk is Studie vindt hydraatkanonhypothese onwaarschijnlijk
Studie vindt hydraatkanonhypothese onwaarschijnlijk Welke invloed hebben temperatuur- en abiotische factoren op organismen?
Welke invloed hebben temperatuur- en abiotische factoren op organismen?  Over de dennenboom Caterpillar
Over de dennenboom Caterpillar
Hoofdlijnen
- Welke soorten cellen delen door mitose en cytokinese?
- Top tien feiten over de menselijke blaas
- Dengue Achilleshiel inzicht biedt hoop op betere vaccins
- Veel meer bacteriën hebben elektrisch geleidende filamenten
- Science Fair Project Ideas for Dentistry
- Genotypes bepalen
- Wat zit er in je tarwe? Wetenschappers voegen het genoom van de meest voorkomende broodtarwe samen
- Wanneer citroenen je leven geven:Herpetofauna-aanpassing aan citrusboomgaarden in Belize
- Hoe verschilt DNA & RNA?
 Stadia van meiose met een beschrijving
Stadia van meiose met een beschrijving  Onderzoekers ontwikkelen nieuwe grafeen nanokanaals waterfilters
Onderzoekers ontwikkelen nieuwe grafeen nanokanaals waterfilters Oligourea-foldamers bootsen peptiden alfa-helices na en binden effectief aan medicijndoelen
Oligourea-foldamers bootsen peptiden alfa-helices na en binden effectief aan medicijndoelen Een krat whisky tijdens COVID
Een krat whisky tijdens COVID Digitaal programmeerbare perovskiet nanodraad-blokcopolymeercomposieten
Digitaal programmeerbare perovskiet nanodraad-blokcopolymeercomposieten Moleculaire files doorbreken met nanoporeuze materialen met vinnen
Moleculaire files doorbreken met nanoporeuze materialen met vinnen NASA ziet een Picasso-achtig gezicht in tropische storm Cimarons krachtige stormen
NASA ziet een Picasso-achtig gezicht in tropische storm Cimarons krachtige stormen Informatie over de moleculaire vorm van virussen die COVID-19 veroorzaken, SARS, en MERS onthult structurele overeenkomsten
Informatie over de moleculaire vorm van virussen die COVID-19 veroorzaken, SARS, en MERS onthult structurele overeenkomsten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | German | Dutch | Danish | Norway | Spanish | Swedish |

-
Wetenschap © https://nl.scienceaq.com