
Wetenschap
Wetenschappers koppelen eicelspecifieke histon H1FOO aan een betere iPS-celgeneratie
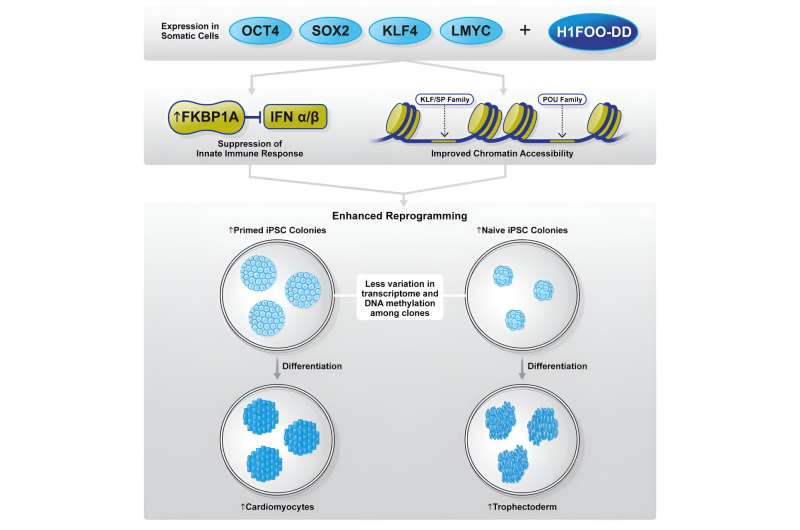
Een gezamenlijk onderzoeksteam onder leiding van Dr. Akira Kunitomi, een voormalig postdoctoraal onderzoeker bij CiRA (momenteel onderzoeker aan het Gladstone Institute of Cardiovascular Disease), en ID Pharma Co., Ltd., heeft de cruciale rol blootgelegd van eicelspecifieke linkerhistone , H1FOO, bij het verbeteren van de herprogrammeringsefficiëntie en homogeniteit voor voorbereide en naïeve pluripotente staten. Het onderzoek is gepubliceerd in Stem Cell Reports .