
Wetenschap
Studie ontdekt dat cellulaire activiteit die erop wijst dat recycling in ons DNA zit
Hoewel je ze misschien niet op prijs stelt, of er zelfs maar van hebt gehoord, zijn er in je hele lichaam talloze microscopisch kleine machines, spliceosomen genaamd, hard aan het werk. Terwijl u zit te lezen, brengen ze getrouw en snel de kapotte informatie in uw genen samen door sequenties te verwijderen die 'introns' worden genoemd, zodat uw boodschapper-RNA's de juiste eiwitten kunnen maken die uw cellen nodig hebben.
Introns zijn misschien wel een van de grootste mysteries van ons genoom. Het zijn DNA-sequenties die de verstandige eiwitcoderende informatie in je genen onderbreken, en moeten worden ‘uitgesplitst’. Het menselijk genoom heeft honderdduizenden introns, ongeveer 7 of 8 per gen, en elk wordt verwijderd door een gespecialiseerd RNA-eiwitcomplex, het 'spliceosoom' genaamd, dat alle introns eruit knipt en de resterende coderende sequenties, exons genaamd, aan elkaar koppelt. Hoe dit systeem van kapotte genen en het spliceosoom zich in onze genomen heeft ontwikkeld, is niet bekend.
Gedurende zijn lange carrière heeft Manny Ares, hoogleraar moleculaire, cellulaire en ontwikkelingsbiologie aan UC Santa Cruz, het tot zijn missie gemaakt om zoveel mogelijk te leren over RNA-splitsing.
"Ik ben helemaal voor het spliceosoom", zei Ares. "Ik wil gewoon alles weten wat het spliceosoom doet, ook al weet ik niet waarom het dat doet."
In een nieuw artikel gepubliceerd in het tijdschrift Genes and Development Ares rapporteert over een verrassende ontdekking over het spliceosoom die ons meer zou kunnen vertellen over de evolutie van verschillende soorten en de manier waarop cellen zich hebben aangepast aan het vreemde probleem van introns. De auteurs laten zien dat nadat het spliceosoom klaar is met het splitsen van het mRNA, het actief blijft en verdere reacties kan aangaan met de verwijderde introns.
Deze ontdekking biedt de sterkste indicatie die we tot nu toe hebben dat spliceosomen in staat zouden kunnen zijn een intron op een andere locatie terug in het genoom te plaatsen. Dit is een vermogen waarvan men voorheen niet dacht dat het spliceosomen bezitten, maar dat een gemeenschappelijk kenmerk is van 'Groep II-introns', verre neven van het spliceosoom dat voornamelijk in bacteriën voorkomt.
Aangenomen wordt dat de spliceosomale introns en Groep II-introns een gemeenschappelijke voorouder delen die verantwoordelijk was voor de verspreiding van introns door het genoom, maar terwijl Groep II-introns zichzelf uit RNA kunnen splitsen en vervolgens rechtstreeks terug in DNA kunnen splitsen, kunnen de 'spliceosomale introns' die worden aangetroffen in De meeste organismen op een hoger niveau hebben het spliceosoom nodig voor splitsing en er werd niet aangenomen dat deze opnieuw in het DNA werd ingebracht. De bevinding van het laboratorium van Ares geeft echter aan dat het spliceosoom vandaag de dag nog steeds introns in het genoom kan inbrengen. Dit is een intrigerende mogelijkheid om te overwegen, omdat introns die opnieuw in het DNA worden geïntroduceerd de complexiteit van het genoom vergroten, en een beter begrip van waar deze introns vandaan komen zou ons kunnen helpen beter te begrijpen hoe organismen blijven evolueren.
Voortbouwend op een interessante ontdekking
De genen van een organisme zijn gemaakt van DNA, waarin vier basen, adenine (A), cytosine (C), guanine (G) en thymine (T), zijn geordend in sequenties die coderen voor biologische instructies, zoals hoe specifieke eiwitten in het lichaam kunnen worden aangemaakt. behoeften. Voordat deze instructies kunnen worden gelezen, wordt het DNA gekopieerd naar RNA door een proces dat bekend staat als transcriptie. Vervolgens moeten de introns in dat RNA worden verwijderd voordat een ribosoom het in daadwerkelijke eiwitten kan vertalen.
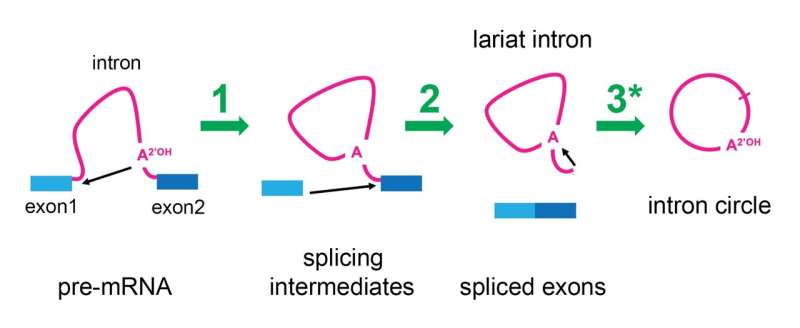
Het spliceosoom verwijdert introns met behulp van een tweestapsproces dat ertoe leidt dat het intron-RNA met één van de uiteinden met het midden is verbonden en een cirkel vormt met een staart die lijkt op de 'lariat' of lasso van een cowboy. Deze verschijning heeft ertoe geleid dat ze "lariat-introns" werden genoemd. Onlangs hebben onderzoekers van Brown University die de locaties van de verbindingslocaties in deze lariaten bestudeerden een vreemde observatie gedaan:sommige introns waren feitelijk cirkelvormig in plaats van lariatvormig.
Deze observatie trok onmiddellijk de aandacht van Ares. Er leek iets te interageren met de lariat-introns nadat ze uit de RNA-sequentie waren verwijderd om hun vorm te veranderen, en het spliceosoom was zijn hoofdverdachte.
"Ik vond dat interessant vanwege dit oude, oude idee over waar introns vandaan kwamen," zei Ares. "Er is veel bewijs dat de RNA-delen van het spliceosoom, de snRNA's, nauw verwant zijn aan Groep II-introns."
Omdat het chemische mechanisme voor splitsing zeer vergelijkbaar is tussen de spliceosomen en hun verre verwanten, de Groep II-introns, hebben veel onderzoekers getheoretiseerd dat wanneer het proces van zelfsplitsing te inefficiënt werd voor Groep II-introns om op betrouwbare wijze zelfstandig te voltooien, delen van deze introns evolueerden tot het spliceosoom. Terwijl introns uit Groep II zichzelf direct weer in het DNA konden invoegen, werd echter niet gedacht dat spliceosomale introns die de hulp van spliceosomen nodig hadden, weer in het DNA zouden worden ingebracht.
"Een van de vragen die in mijn hoofd in dit verhaal ontbrak, was:is het mogelijk dat het moderne spliceosoom nog steeds in staat is een lariat-intron te nemen en dit ergens in het genoom in te voegen?" zei Ares. "Is het nog steeds in staat om te doen wat het vooroudercomplex deed?"
Om deze vraag te kunnen beantwoorden, besloot Ares te onderzoeken of het inderdaad het spliceosoom was dat veranderingen aanbracht in de lariat-introns om hun staarten te verwijderen. Zijn laboratorium vertraagde het splitsingsproces in gistcellen en ontdekte dat nadat het spliceosoom het mRNA had vrijgegeven waarvan het klaar was met het splitsen van introns, het zich aan intronlariaten vasthield en deze omvormde tot echte cirkels. Het Ares-lab was in staat gepubliceerde RNA-sequentiegegevens van menselijke cellen opnieuw te analyseren en ontdekte dat menselijke spliceosomen dit vermogen ook hadden.
"We zijn hier enthousiast over, want hoewel we niet weten wat dit circulaire RNA zou kunnen doen, suggereert het feit dat het spliceosoom nog steeds actief is, dat het mogelijk de insertie van het lariat-intron terug in het genoom kan katalyseren," zei Ares.
Als het spliceosoom het intron opnieuw in het DNA kan inbrengen, zou dit ook aanzienlijk gewicht toevoegen aan de theorie dat spliceosomen en Groep II-introns lang geleden een gemeenschappelijke voorouder deelden.
Een theorie testen
Nu Ares en zijn laboratorium hebben aangetoond dat het spliceosoom het katalytische vermogen heeft om hypothetisch introns terug in het DNA te plaatsen, zoals hun voorouders deden, is de volgende stap dat de onderzoekers een kunstmatige situatie moeten creëren waarin ze een DNA-streng aan een DNA-streng ‘voeden’. spliceosoom dat nog steeds vastzit aan een lariat-intron en kijken of ze het daadwerkelijk kunnen krijgen om het intron ergens in te voegen, wat een "proof of concept" voor deze theorie zou opleveren.
Als het spliceosoom in staat is om introns opnieuw in het genoom in te brengen, zal dit bij mensen waarschijnlijk een zeer zeldzame gebeurtenis zijn, omdat er ongelooflijk veel vraag is naar de menselijke spliceosomen en daarom niet veel tijd te besteden hebben aan verwijderde introns. In andere organismen waar het spliceosoom niet zo druk is, kan het opnieuw inbrengen van introns vaker voorkomen. Ares werkt nauw samen met UCSC Biomolecular Engineering Professor Russ Corbett-Detig, die onlangs een systematische en uitgebreide jacht heeft geleid naar nieuwe introns in de beschikbare genomen van alle intron-bevattende soorten, die werd gepubliceerd in het tijdschrift Proceedings of the National Academy van Wetenschappen (PNAS ) vorig jaar.
Het artikel in PNAS toonde aan dat intron-‘burst’-gebeurtenissen ver terug in de evolutionaire geschiedenis waarschijnlijk duizenden introns in één keer in een genoom hebben geïntroduceerd. Ares en Corbett-Detig werken er nu aan om een burst-gebeurtenis kunstmatig na te bootsen, waardoor ze inzicht krijgen in hoe genomen reageerden toen dit gebeurde.
Ares zei dat zijn interdisciplinaire samenwerking met Corbett-Detig de deuren voor hen heeft geopend om zich echt te verdiepen in enkele van de grootste mysteries over introns die voor hen waarschijnlijk onmogelijk volledig te begrijpen zouden zijn zonder hun gecombineerde expertise.
"Het is de beste manier om dingen te doen", zei Ares. "Als je iemand tegenkomt die dezelfde soort vragen in gedachten heeft, maar met een andere set van methoden, perspectieven, vooroordelen en rare ideeën, wordt dat spannender. Dat geeft je het gevoel dat je een probleem als dit kunt oplossen en oplossen. Dat is heel complex."