
Wetenschap
Een eenvoudigere manier om eiwitten te maken kan leiden tot nieuwe nanomedicijnen
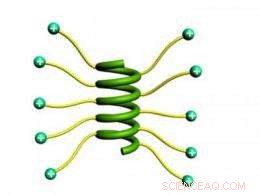
Onderzoekers ontdekten dat langwerpige zijketens met geladen uiteinden ervoor zorgden dat korte eiwitten zich in een stabiele helix konden kronkelen. Krediet:Jianjun Cheng, Universiteit van Illinois
Onderzoekers hebben een eenvoudige methode ontwikkeld om korte eiwitketens te maken met spiraalvormige structuren die ook in water kunnen oplossen, twee wenselijke eigenschappen die niet vaak samen worden gevonden. Dergelijke structuren kunnen toepassingen hebben als bouwstenen voor zelfassemblerende nanostructuren en als middelen voor medicijn- en genafgifte.
Onder leiding van Jianjun Cheng, een professor in materiaalkunde en techniek aan de Universiteit van Illinois, het onderzoeksteam zal zijn bevindingen publiceren in de editie van 22 februari van het tijdschrift Natuurcommunicatie .
Materiaalwetenschappers zijn geïnteresseerd in het ontwerpen van grote polymeermoleculen die kunnen worden gebruikt als bouwstenen voor zelfassemblerende structuren. De uitdaging was dat de moleculen over het algemeen een bolvormige, bolvorm, beperking van hun vermogen om ordelijke aggregaten te vormen. Echter, Polypeptiden – ketens van aminozuren zoals eiwitten – kunnen helixstructuren vormen. Korte polypeptideketens die een spiraalvorm aannemen, werken als cilindrische staafjes.
"Als je twee stijve staven hebt, een positieve en een negatieve, vlak naast elkaar, ze gaan aan elkaar plakken. Als je een manier hebt om de lading op het oppervlak te leggen, dan kunnen ze samen in een close, compacte manier, zodat ze een driedimensionale structuur vormen, ' zei Chen.
Echter, het is moeilijk om spiraalvormige polypeptiden te maken die in water oplosbaar zijn, zodat ze in oplossing kunnen worden gebruikt. Polypeptiden halen hun oplosbaarheid uit zijketens - moleculaire structuren die voortkomen uit elke aminozuurlink in de polypeptideketen. Aminozuren met positieve of negatieve ladingen in hun zijketens zijn nodig om een polypeptide in water te laten dispergeren.
Het probleem doet zich voor wanneer kettingen met geladen zijketens spiraalvormige structuren vormen. De ladingen veroorzaken een sterke afstoting tussen de zijketens, die de spiraalvormige conformatie destabiliseert. Dit zorgt ervoor dat in water oplosbare polypeptiden willekeurige spiraalstructuren vormen in plaats van de gewenste helices.
Bij het zoeken naar oplossingen voor het raadsel van spiraalvormige, in water oplosbare polypeptiden, onderzoekers hebben verschillende gecompliceerde methoden geprobeerd. Bijvoorbeeld, wetenschappers hebben geprobeerd zeer in water oplosbare chemicaliën aan de zijketens te enten om de algehele oplosbaarheid van de polypeptiden te vergroten, of het creëren van helices met slechts aan één kant ladingen.
"Je kunt de helixstructuur en de oplosbaarheid bereiken, maar je moet de helixstructuur op een heel speciale manier ontwerpen. Het peptide-ontwerp heeft een heel specifieke sequentie nodig. Dan ben je erg beperkt in het type polypeptide dat je kunt bouwen, en het is niet eenvoudig om deze polypeptiden te ontwerpen of te hanteren, ' zei Chen.
In tegenstelling tot, De groep van Cheng ontwikkelde een zeer eenvoudige oplossing. Omdat de nabijheid van de ladingen de afstoting veroorzaakt die de helix verstoort, de onderzoekers verlengden simpelweg de zijketens, de ladingen verder van de ruggengraat te verplaatsen en ze meer vrijheid te geven om afstand van elkaar te houden.
De onderzoekers merkten op dat naarmate ze de lengte van de zijketens met ladingen aan het uiteinde vergrootten, de neiging van de polypeptiden om helices te vormen nam ook toe.
"Het is zo'n eenvoudig idee - verplaats de lading weg van de ruggengraat, " zei Cheng. "Het is helemaal niet moeilijk om de langere zijketens te maken, en het heeft verbazingwekkende eigenschappen voor het opwinden van spiraalvormige structuren door simpelweg de afstand tussen de lading en de ruggengraat te vergroten."
De groep ontdekte dat niet alleen polypeptiden met lange zijketens helices vormen, ze vertonen een opmerkelijke stabiliteit, zelfs in vergelijking met niet-geladen helices. De helices lijken immuun voor temperatuur, pH, en andere denaturerende middelen die de meeste polypeptiden zouden afwikkelen.
Dit kan verklaren waarom aminozuren met grote hydrofobe zijketens niet in de natuur voorkomen. Een dergelijke onveranderlijkheid zou het dynamisch op- en afwikkelen van eiwitstructuren uitsluiten, wat essentieel is voor veel biologische processen. Echter, rigide stabiliteit is een wenselijke eigenschap voor de soorten toepassingen die de groep van Cheng onderzoekt:nanostructuren voor medicijn- en genafgifte, met name gericht op kankertumoren en stamcellen.
"We willen de correlatie van de lengtes van de helices en de circulatie in het lichaam testen om te zien wat de impact is van de vorm en de lading en de zijketens voor speling in het lichaam, "Zei Cheng. "Recente studies tonen aan dat de aspectverhouding van de nanostructuren - bolvormige structuren versus buizen - een enorme impact heeft op de penetratie van tumorweefsels en de halfwaardetijden van de bloedsomloop in het lichaam."
Cheng is van plan een bibliotheek te creëren van korte spiraalvormige polypeptiden met verschillende ruggengraatlengtes, zijketen lengtes en soorten lading. Hij hoopt de chemie nog verder te vereenvoudigen en de materialen breed toegankelijk te maken. Zijn laboratorium heeft al aangetoond dat helixstructuren effectieve genafgifte- en membraantransductiemiddelen kunnen zijn, en het bouwen van de bibliotheek van oplosbare spiraalvormige moleculen zal verder onderzoek mogelijk maken om dergelijke nanostructuren op maat te maken voor specifieke biomedische toepassingen.
 Grondstoffen achter helft van wereldwijde emissies:UN
Grondstoffen achter helft van wereldwijde emissies:UN Detectie van microplastics eerste stap bij beoordeling van milieuschade
Detectie van microplastics eerste stap bij beoordeling van milieuschade De verbinding tussen zonnecyclus en winterweer in de Noord-Atlantische Oceaan ontkrachten
De verbinding tussen zonnecyclus en winterweer in de Noord-Atlantische Oceaan ontkrachten Offshore olie- en gasboringen verbieden
Offshore olie- en gasboringen verbieden Meer van Maracaibo, bliksem hoofdstad van de wereld
Meer van Maracaibo, bliksem hoofdstad van de wereld
Hoofdlijnen
- Waarom zie je nooit vierkante groenten?
- Veel vis in de zee? Niet noodzakelijk, zoals de geschiedenis laat zien
- Gebruik van DNA Extraction
- Maakt Thanksgiving Turkije je echt slaperig?
Als je Thanksgiving-ritueel gepaard gaat met flauwvallen op de bank na een maaltijd, weet je al dat een feest met alles erop en eraan je moe maakt. Maar ondertekende de kalkoen je enkeltje naar snoozevil
- Eenmaal uitgestorven verklaard, Lord Howe Island wandelende takken leven echt
- Biotechnologie en genetische manipulatie: een overzicht
- Noordelijke blootstelling:fossielen van een zuidelijke walvis voor het eerst gevonden in het noorden
- Hoe isoleer ik bacteriën uit de bodem?
- De evolutionaire oorsprong van de darm
- Zelfs gekko's kunnen hun grip verliezen

- Hydrogel onthoudt zijn vorm

- Engineering-ontdekking daagt het paradigma van warmteoverdracht uit dat richting geeft aan het ontwerp van elektronische en fotonische apparaten
- Menselijke korsten dienen als inspiratie voor nieuw verband om genezing te versnellen

- Water is belangrijk voor metalen nanodeeltjes

 Glacioloog probeert de impact van de opwarming van de aarde op de Aziatische gletsjers te kwantificeren
Glacioloog probeert de impact van de opwarming van de aarde op de Aziatische gletsjers te kwantificeren Alles wat je nooit wilde weten over bedwantsen, en meer
Alles wat je nooit wilde weten over bedwantsen, en meer Optische bedrading voor grote kwantumcomputers
Optische bedrading voor grote kwantumcomputers Rechtbanken AT&T-Time Warner-uitspraak duidelijk onjuist:Amerikaanse regering
Rechtbanken AT&T-Time Warner-uitspraak duidelijk onjuist:Amerikaanse regering 9e graad FCAT Math Tutorial
9e graad FCAT Math Tutorial  Pandemische vrachtemissies bereikten de doelstelling voor 2030 in slechts enkele maanden. Hoe zorgen we ervoor dat de veranderingen blijven hangen?
Pandemische vrachtemissies bereikten de doelstelling voor 2030 in slechts enkele maanden. Hoe zorgen we ervoor dat de veranderingen blijven hangen? Hoe Bunker Busters werken
Hoe Bunker Busters werken  Gouden nanodeeltjes die in tumoren worden geïnjecteerd, kunnen de bestralingsbehandeling voor kanker verbeteren
Gouden nanodeeltjes die in tumoren worden geïnjecteerd, kunnen de bestralingsbehandeling voor kanker verbeteren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

