
Wetenschap
Hoe een iconische foto van een appel de inspiratie vormde voor een verbeterde celanalyse
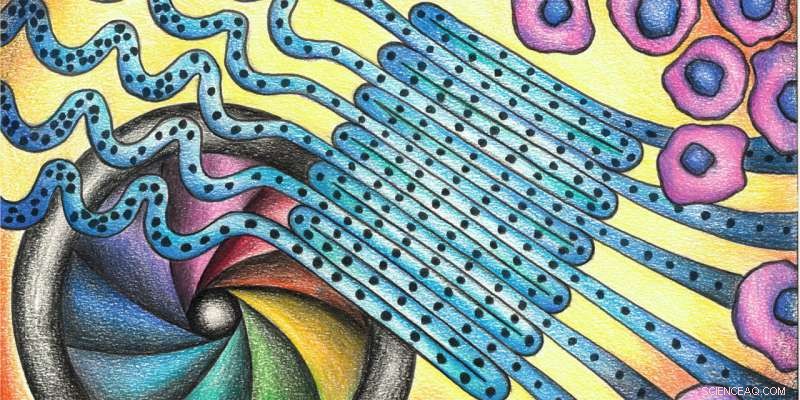
Een bewezen methode vereenvoudigd:veel cellen stromen door parallelle lussen, waardoor ze samen kunnen worden gemeten in plaats van na elkaar. Krediet:deMello Group/Chem
Het identificeren van een klein aantal pathogene cellen tussen vele miljoenen cellen is lastig. Onderzoekers van ETH Zürich hebben nu een technologie ontwikkeld die in staat is om op kleine schaal enorme hoeveelheden celeigenschappen te identificeren, individueel en gedetailleerd.
Alle levensprocessen bij de mens, dieren en planten zijn afhankelijk van cellulaire activiteit. Het menselijk lichaam alleen al bevat meer dan 210 celtypes met specifieke eigenschappen en functies die de ontwikkeling en gezondheid beïnvloeden. Een gedetailleerd begrip van deze cellen en hun eigenschappen is cruciaal voor biologie en geneeskunde. Echter, het filteren van de gewilde celinformatie is soms een enorme uitdaging - vooral als, uit een miljoen cellen, minder dan een dozijn hebben de eigenschap die een ziekte veroorzaakt.
Een gevestigde methode in de chemie, biologie en geneeskunde om snel de eigenschappen van grote aantallen individuele cellen te bepalen, is flowcytometrie. Deze celmeettechnologie kan worden gebruikt, bijvoorbeeld, om kankercellen of T-cellen te identificeren, die witte bloedcellen die belangrijk zijn voor het immuunsysteem.
De technologie werd uitgevonden in 1968, met conventionele flowcytometers die normaal verstrooid licht en fluorescentie meten wanneer cellen door een laserstraal stromen. De resulterende signalen variëren afhankelijk van de grootte, vorm, structuur en kleur van de cellen; bijvoorbeeld, T-cellen zijn erg glad en verstrooien minder licht dan andere cellen.
Een goede combinatie
De onderzoeksgroep onder leiding van Andrew deMello, ETH-hoogleraar biochemische technologie, is er nu in geslaagd om flowcytometrie aanzienlijk verder te ontwikkelen. Het op beeldvorming gebaseerde cytometrieplatform meet cellen en hun eigenschappen sneller, in grotere hoeveelheden en veel nauwkeuriger dan de huidige flowcytometers. De onderzoekers van ETH Zürich hebben nu de werking van hun methode gepresenteerd in het wetenschappelijke tijdschrift Chemo .
De onderzoekers hebben de aanpak niet opnieuw uitgevonden, maar eerder slim gecombineerd bestaande technologieën:hun flowcytometer combineert de mogelijkheden van microfluïdica, die het gedrag van vloeistoffen door microkanalen bestudeert, met zeer gevoelige optische detectiemethoden en ultrasnelle beeldvorming.
Hierdoor kunnen ze een ultrahoge doorvoer van meer dan 50, 000 cellen per seconde. Standaard op fluorescentie gebaseerde flowcytometers meten betrouwbaar tussen 100 en 20, 000 cellen per seconde, en imaging flowcytometers slechts tot 4, 000 cellen per seconde. In praktijk, echter, het is normaal dat er aanzienlijk minder cellen worden gemeten omdat ze gewoonlijk samenklonteren.
"We ontwikkelen technologieën om scheikundigen te helpen, biologen en medisch specialisten doen nieuw onderzoek, ", zegt deMello. Hij verwacht dat het platform ooit ook eenvoudiger en veel goedkoper zal zijn dan de instrumenten van vandaag.
In principe, hun flowcytometer bestaat uit drie delen:aan het begin, de cellen staan dicht op elkaar in een enkel bestand. Een microfluïdische stroom leidt ze vervolgens met hoge snelheid door een kronkelig microkanaal (zie de tekening hierboven) en in het detectiegebied. Daar, een camera met hoge resolutie registreert hun grootte, vorm en structuur met behulp van de lichteffecten. In een laatste stap, ze kunnen worden gesorteerd op basis van hun eigenschappen.
Snapshots op loops
Een bijzonder kenmerk van deze benadering is dat de cellen door verschillende parallelle lussen gaan, waardoor de camera grote aantallen cellen met precisie kan opnemen. Dit versnelt de methode van deMello, en maakt het mogelijk om bij uitzonderlijk hoge doorvoersnelheden te werken. "De combinatie van microvloeistoffen met beeldvorming maakt het mogelijk om informatie te verbeteren, "zegt hij. In conventionele benaderingen, in tegenstelling tot, een detector registreert de ene cel na de andere op een bepaald punt.

Een klassieker:"Bullet through Apple" (1964), Harold Edgerton. Krediet:© 2010 MIT. Met dank aan MIT Museum
Met deze technologie kunnen drie soorten afbeeldingen worden verkregen:donkerveldafbeeldingen met informatie over de vorm en structuur van een cel (deze afbeeldingen tonen gekleurde structuren tegen een donkere achtergrond), helderveldafbeeldingen met informatie over de celgrootte en fluorescerende afbeeldingen met informatie over het uiterlijk en de interne structuur van een cel. Met name de extractie van morfologische informatie onderscheidt deMello's benadering van andere fluorescerende of microvloeistof-gebaseerde benaderingen.
Imaging als Papa Flash
Toen ze tegen een probleem aanliepen, DeMello's groep profiteerde van de jarenlange ervaring in op druppeltjes gebaseerde microfluïdica en optische methoden:wanneer druppeltjes, cellen of microdeeltjes stromen zeer snel, de beelden worden – net als bij foto’s – soms vervormd of wazig. De onderzoeksgroep loste dit probleem op door te leren van het verleden:de cellen blootleggen, ze gebruikten stroboscopische verlichting die de continue stroom cellen - zoals een slow motion-camera - afbreekt in een reeks stilstaande beelden. Deze methode werd wereldberoemd dankzij de uitvinder van de stroboscoopflitser, Harold E. Edgerton, ook bekend als Papa Flash, wiens cultfoto's uit de jaren zestig over de hele wereld werden gezien.
Dankzij stroboscopische belichting, individuele cellen die met een halve meter per seconde en in grote hoeveelheden bewegen, kunnen duidelijk worden geregistreerd.
Om de prestaties van hun methode te testen, deMello's senior wetenschapper, Stavros Stavrakis, samen met twee afgestudeerde studenten een grote celpopulatie en gedifferentieerd leven geanalyseerd, stervende en dode cellen op basis van hun fluorescentie. De onderzoekers van ETH Zürich willen de methode graag verder ontwikkelen met het oog op bacteriële, nanowetenschappelijke en industriële toepassingen.
 Feiten over babygiraffen
Feiten over babygiraffen Seine bereikt hoogtepunt in door overstromingen getroffen Parijs
Seine bereikt hoogtepunt in door overstromingen getroffen Parijs Onderzoekers gebruiken een datagestuurde aanpak om aardbevingen minder schadelijk te maken
Onderzoekers gebruiken een datagestuurde aanpak om aardbevingen minder schadelijk te maken Onlangs ontdekt mineraal genoemd naar LSU-professor
Onlangs ontdekt mineraal genoemd naar LSU-professor Afrika moet voedsel beheren, water en energie op een manier die alle drie met elkaar verbindt
Afrika moet voedsel beheren, water en energie op een manier die alle drie met elkaar verbindt
Hoofdlijnen
- Wat is Lambda Max?
- Woedend debat:houdt het ruimen van wolven stroperij tegen?
- Neushoornstroper krijgt 20 jaar cel in Zuid-Afrika
- Waarom het de menselijke natuur is om onze instincten te negeren
- Australische honden getraind om bedreigde diersoorten op te sporen
- Drie mechanismen van genetische recombinatie in Prokaryotes
- 2 Voorbeelden van Heterozygote eigenschappen
- Soorten spijsverteringsenzymen
- Hoe snel is een knipoog?
- Zwakke sociale banden een moordenaar voor mannelijke walvissen

- Plankton is de kleinste onbezongen held op aarde
- Ver van harpoenen, walvissen schitteren in de boom van ecotoerisme in IJsland

- Nieuwe mobiele app diagnosticeert gewasziekten in het veld en waarschuwt boeren op het platteland

- Zelfvernietiging van muggen

 Purdue foneemproject creëert nieuwe toekomst voor haptische communicatie
Purdue foneemproject creëert nieuwe toekomst voor haptische communicatie Mobiele technologie kan underbanked dienen zonder cryptocurrency
Mobiele technologie kan underbanked dienen zonder cryptocurrency Satelliet ziet Atlantische tropische depressie 14 vormen voor de westkust van Afrika
Satelliet ziet Atlantische tropische depressie 14 vormen voor de westkust van Afrika 12 doden bij overstromingen in Vietnam aardverschuivingen
12 doden bij overstromingen in Vietnam aardverschuivingen Wat zijn enkele van de krachten die landvormen veranderen?
Wat zijn enkele van de krachten die landvormen veranderen?  Water speelt een sleutelrol bij de katalytische omzetting van methaan in methanol
Water speelt een sleutelrol bij de katalytische omzetting van methaan in methanol Warmer watersignalen veranderen voor Schotse shags
Warmer watersignalen veranderen voor Schotse shags P450-peroxygenase omzetten in peroxidase via mechanismegestuurde eiwittechnologie
P450-peroxygenase omzetten in peroxidase via mechanismegestuurde eiwittechnologie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

