
Wetenschap
Water speelt een sleutelrol bij de katalytische omzetting van methaan in methanol
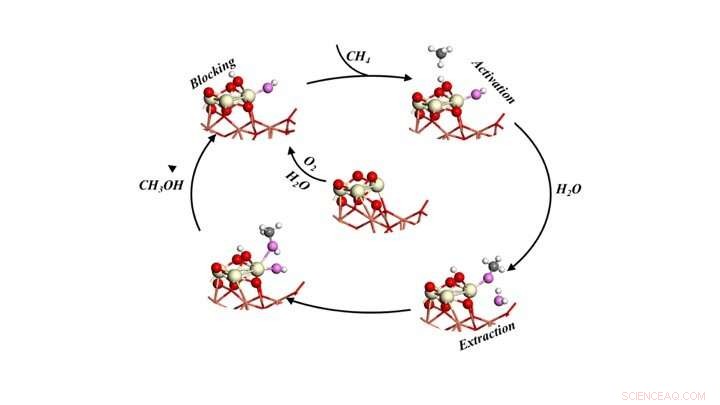
Katalytische cyclus voor het selectief omzetten van methaan in methanol door het methaan bloot te stellen aan zuurstof en water. Krediet:Brookhaven National Laboratory
Wetenschappers van het Brookhaven National Laboratory van het Amerikaanse ministerie van Energie en medewerkers hebben nieuwe details onthuld die verklaren hoe een zeer selectieve katalysator methaan omzet, het hoofdbestanddeel van aardgas, naar methanol, een gemakkelijk te transporteren vloeibare brandstof en grondstof voor het maken van kunststoffen, verven, en andere basisproducten. De bevindingen kunnen helpen bij het ontwerpen van nog efficiëntere/selectieve katalysatoren om methaanconversie een economisch levensvatbaar en milieuvriendelijk alternatief te maken voor het afblazen of affakkelen van "afvalgas".
Zoals beschreven in een artikel dat verschijnt in Wetenschap , het team gebruikte op theorie gebaseerde modellen en simulaties om de herschikkingen op atomair niveau te identificeren die plaatsvinden tijdens de reactie, en voerde vervolgens experimenten uit om die details te verifiëren. De studies onthulden drie essentiële rollen voor water, werken in combinatie met een economische cerium-oxide/koper-oxide katalysator, om de omzetting van methaan in methanol met 70 procent selectiviteit te bewerkstelligen en ongewenste nevenreacties te blokkeren.
"We wisten van eerder werk dat we een zeer selectieve katalysator hadden ontwikkeld voor de directe omzetting van methaan in methanol in aanwezigheid van water, " zei Brookhaven Lab-chemicus Sanjaya Senanayake, die het project leidde. "Maar nu, met behulp van geavanceerde theoretische en experimentele technieken, we hebben geleerd waarom het zo goed werkt."
De bevindingen zouden de ontwikkeling kunnen versnellen van katalysatoren die gebruikmaken van methaan dat ontsnapt uit gas- en oliebronnen, waar het meestal rechtstreeks in de atmosfeer wordt afgevoerd of wordt afgebrand.
"Het transport van gas is extreem moeilijk en potentieel gevaarlijk, "Zei Senanayake. "Maar als je het direct in een vloeistof omzet, kun je het verplaatsen en gebruiken in plaats van het verspillend te laten affakkelen. Hoewel het commercialiseringspotentieel voor een dergelijke reactie nog enkele jaren kan duren, we hopen dat onze resultaten en het begrip van hoe het allemaal werkt, zullen helpen om er sneller te komen."
Theorie legt de basis
De zoektocht naar methaan-naar-methanolkatalysatoren heeft enkele veelbelovende vooruitzichten opgeleverd. Maar veel werken in verschillende afzonderlijke stappen met hoge energievereisten. En in veel gevallen concurrerende reacties breken het methaan (en eventueel geproduceerde methanol) volledig af tot koolmonoxide (CO) en CO2. Dus, toen het Brookhaven-team voor het eerst opmerkte dat hun katalysator methaan direct kon omzetten in methanol met een hoge opbrengst in één continue reactie, ze wilden meer weten over hoe het deze moeilijke taak uitvoerde.
Ze waren vooral geïnteresseerd in de rol van water, die belangrijke stappen in het proces leek te vergemakkelijken en op de een of andere manier de reactiepaden blokkeerde die CO en CO2 produceerden.
Met behulp van rekenhulpmiddelen in Brookhaven Lab's Centre for Functional Nanomaterials (CFN), Brookhaven's Scientific Data and Computing Center, Stony Brook University (SBU), en het National Energy Research Scientific Computing Center (NERSC) in het Lawrence Berkeley National Laboratory van DOE (Berkeley Lab), Brookhaven-chemicus Ping Liu ontwikkelde de theoretische benadering om erachter te komen wat er aan de hand was.
Eerst, ze gebruikte "density functional theory" (DFT) berekeningen om te bepalen hoe de reactanten (methaan, zuurstof, en water) veranderden terwijl ze in wisselwerking stonden met elkaar en de ceriumoxide/koperoxidekatalysator in verschillende stadia tijdens de reactie. Deze berekeningen bevatten ook informatie over hoeveel energie het zou kosten om van de ene atomaire opstelling naar de andere te komen.
"De DFT geeft je een aantal 'momentopnamen' van de fasen die betrokken zijn bij de reactie en de 'hobbels' of barrières die je moet overwinnen om van de ene fase naar de volgende te komen, " ze legde uit.
Daarna voerde ze 'kinetische Monte Carlo'-simulaties uit, waarbij ze voornamelijk computers gebruikte om alle mogelijke manieren uit te proberen waarop de reactie van momentopname naar momentopname kon verlopen. De simulaties houden rekening met alle mogelijke paden en energievereisten om van de ene fase naar de volgende te gaan.
"Deze simulaties beginnen met elke tussenfase en kijken naar alle mogelijkheden die naar de volgende stap kunnen gaan - en uitzoeken wat het meest waarschijnlijke pad is, " zei Liu. "De simulaties bepalen de meest waarschijnlijke manier waarop de snapshots in realtime kunnen worden verbonden."
De simulaties modelleren ook hoe verschillende reactieomstandigheden, bijvoorbeeld veranderingen in druk en temperatuur - zullen de reactiesnelheden en de waarschijnlijke routes beïnvloeden.
"Er waren 45-50 mogelijke componenten in het 'reactienetwerk' dat we simuleerden, " zei José Rodriguez, een leider van Brookhaven's katalysegroep die ook een gezamenlijke aanstelling heeft bij SBU. "Van die, Ping, Erwei Huang, en Wenjie Liao, twee Ph.D. studenten aan de SBU, konden voorspellen wat de gunstigste omstandigheden zouden zijn, de beste weg, om van methaan naar methanol te gaan en niet naar CO en CO2 - en dat allemaal veroorzaakt door de aanwezigheid van water."
De modellen voorspelden drie rollen voor water:1) het activeren van het methaan (CH4) door een koolstof-waterstofbinding te verbreken en een -OH-groep te verschaffen om het CH3-fragment om te zetten in methanol, 2) het blokkeren van reactieve sites die mogelijk methaan en methanol kunnen omzetten in CO en CO2, en 3) de verplaatsing van op het oppervlak gevormde methanol in de gasfase als product vergemakkelijkt.
"Alle actie vindt plaats op een of twee actieve plaatsen op het grensvlak tussen de ceriumoxide-nanodeeltjes en de koperoxidefilm waaruit onze katalysator bestaat, ' zei Senanayake.
Maar deze beschrijving was nog steeds slechts een model. De wetenschappers hadden bewijs nodig.

Brookhaven Lab en Stony Brook University (SBU) leden van het onderzoeksteam. Eerste rij, van links naar rechts:Sanjaya Senanayake (Brookhaven), Mausumi Mahapatra (Brookhaven), José A Rodriguez (Brookhaven), Ping Liu (Brookhaven) en Wenjie Liao (SBU). Tweede rij:Ivan Orozco (SBU), Ning Rui (Brookhaven), Zongyuan Liu (Brookhaven) en Erwei Huang (SBU). Krediet:Brookhaven National Laboratory
Experimenten leveren bewijs
Om bewijs te verzamelen, de wetenschappers van Brookhaven en SBU voerden aanvullende experimenten uit in de laboratoria van Brookhaven's Chemistry Division en maakten verschillende reizen naar de Advanced Light Source (ALS) in Berkeley Lab. Dit team omvatte SBU Ph.D. student Ivan Orozco en postdoctorale fellows Zongyuan Liu, Robert M. Palomino, Ning Rui, en Mausumi Mahapatra.
Bij de ALS, de groep werkte samen met Berkeley Lab's Slavomir Nemsak en medewerkers Thomas Duchon (Peter-Grünberg-Institut in Duitsland) en David Grinter (Diamond Light Source in het Verenigd Koninkrijk) om experimenten uit te voeren met behulp van omgevingsdruk (AP) röntgenfoto-elektronenspectroscopie (XPS) , waardoor ze de reactie in realtime konden volgen om belangrijke stappen en tussenproducten te identificeren.
"De röntgenstralen wekken elektronen op, en de energie van de elektronen vertelt je welke chemische soort je op het oppervlak hebt en de chemische toestand van de soort. Het maakt een 'chemische vingerafdruk'", zei Rodriguez. "Met deze techniek, je kunt de oppervlaktechemie en het reactiemechanisme in realtime volgen."
Het uitvoeren van de reactie met en zonder water onder verschillende omstandigheden bevestigde dat water de voorspelde drie rollen speelde. De metingen lieten zien hoe de reactieomstandigheden het proces vooruit brachten en de productie van methanol maximaliseerden door nevenreacties te voorkomen.
"We hebben direct bewijs gevonden voor de vorming van CH3O - een tussenproduct voor methanol - in de aanwezigheid van water, " zei Rodriguez. "En omdat je het water hebt, je wijzigt alle oppervlaktechemie om de nevenreacties te blokkeren, en laat de methanol ook gemakkelijk los van het katalysatoroppervlak, zodat het niet ontleedt."
"Nu we de ontwerpprincipes voor de katalysator hebben geïdentificeerd, "Senanayake zei, "Vervolgens moeten we een echt systeem bouwen om zo'n katalysator te gebruiken en het testen - en kijken of we het kunnen verbeteren."
 Chemische ingenieurs publiceren paper waarin theorieën over glasovergang worden uitgedaagd
Chemische ingenieurs publiceren paper waarin theorieën over glasovergang worden uitgedaagd Alles samenvoegen:inspiratie voor taaie en zelfherstellende materialen
Alles samenvoegen:inspiratie voor taaie en zelfherstellende materialen Een nieuwe methode voor kwantitatieve schatting van de mate van overeenkomst van coördinatieveelvlakken
Een nieuwe methode voor kwantitatieve schatting van de mate van overeenkomst van coördinatieveelvlakken Nieuwe naaldloze vaccins kunnen het einde van de griepprik betekenen
Nieuwe naaldloze vaccins kunnen het einde van de griepprik betekenen Hoe de steno-elektronenconfiguratie voor Lead
Hoe de steno-elektronenconfiguratie voor Lead
Hoofdlijnen
- Duurzaamheid van visserij gekoppeld aan genderrollen onder handelaren
- Biology Speech Topics
- Trofisch niveau (voedselketen en web): definitie en voorbeelden (met diagram)
- Geërgerd door andere volkeren friemelen? Studie zegt dat je niet alleen bent
- Waarom zijn cellen belangrijk voor levende organismen?
- Onderzoeker onderzoekt de rol van kleine RNA's in communicatie tussen cellen
- Wie geeft er om WA-uilen?
- Zelfs koude harde contanten zijn niet genoeg stimulans om naar tegengestelde meningen te luisteren
- Een stap dichter bij gewassen met twee keer de opbrengst
- Een methode om verborgen serienummers van polymeerproducten te herstellen

- Onderzoekers maken apparaat om risico's voor borstkanker te identificeren

- Een manier om kunstmatige intelligentie te gebruiken om chemische reacties te voorspellen
- Wiebelen en wiebelen:studie legt uit hoe organismen evolueren om bij verschillende temperaturen te leven

- Atoombeeld van de verbazingwekkende moleculaire machines van de natuur aan het werk

 Optische technieken bieden snelle, efficiënte COVID-19-detectie
Optische technieken bieden snelle, efficiënte COVID-19-detectie Toerisme voornamelijk verantwoordelijk voor zwerfvuil op mediterrane stranden
Toerisme voornamelijk verantwoordelijk voor zwerfvuil op mediterrane stranden Revenge of the seabed burrowers:een andere kijk op bioturbatie en oceaanecosystemen
Revenge of the seabed burrowers:een andere kijk op bioturbatie en oceaanecosystemen Rusland test soeverein internet uit angst voor online isolement
Rusland test soeverein internet uit angst voor online isolement Regen-op-sneeuw overstromingsrisico neemt toe in veel berggebieden in het westen van de VS, Canada
Regen-op-sneeuw overstromingsrisico neemt toe in veel berggebieden in het westen van de VS, Canada Welke broodvormen sneller zijn?
Welke broodvormen sneller zijn?  Betere RNA-interferentie, geïnspireerd door de natuur:nieuwe nanodeeltjes bieden de beste genuitschakeling ooit
Betere RNA-interferentie, geïnspireerd door de natuur:nieuwe nanodeeltjes bieden de beste genuitschakeling ooit Retrospectieve test voor kwantumcomputers kan vertrouwen opbouwen
Retrospectieve test voor kwantumcomputers kan vertrouwen opbouwen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

