
Wetenschap
Het doorbreken van barrières bij de toediening van medicijnen met betere lipide-nanodeeltjes
Veel ziekten kunnen met succes worden behandeld in de eenvoudige omgeving van een celkweekschaaltje, maar om echte mensen succesvol te kunnen behandelen, moet het medicijn een reis maken door de oneindig veel complexere omgeving in ons lichaam en intact in de aangetaste cellen aankomen. Dit proces, dat medicijnafgifte wordt genoemd, is een van de belangrijkste barrières in de geneeskunde.
Een samenwerking tussen Lawrence Berkeley National Laboratory (Berkeley Lab) en Genentech, lid van de Roche Group, werkt aan het doorbreken van enkele van de knelpunten bij de medicijnafgifte door het ontwerpen van de meest effectieve lipidenanodeeltjes (LNP’s) – kleine bolvormige zakjes gemaakt van vetmoleculen die therapeutische middelen inkapselen totdat ze zich aan de celmembranen hechten en hun inhoud vrijgeven. Het eerste medicijn dat gebruik maakte van LNP's werd in 2018 goedgekeurd, maar de toedieningsmethode kreeg wereldwijde bekendheid met de mRNA-COVID-vaccins van Pfizer en Moderna.
"Het is een behoorlijk slim systeem, want als je het RNA alleen maar aan het menselijk lichaam aflevert, wordt het RNA afgebroken door nucleasen en kan het vanwege zijn grootte en lading niet gemakkelijk het celmembraan passeren, maar de LNP's leveren het veilig af in de cel. ", legt co-hoofdauteur Chun-Wan Yen uit, een senior hoofdwetenschapper bij Genentech's Small Molecule Pharmaceutical Sciences-groep.
LNP's worden nu op grote schaal onderzocht als toedieningssysteem voor vaccins voor andere infectieziekten of therapeutische vaccins voor kanker. De levensvatbaarheid van deze nieuwe toepassingen zal afhangen van hoe goed de lipidenenveloppen samensmelten met doelcellen, hoe stabiel de geneesmiddel-LNP-formuleringen zijn opgeslagen (zodat ze een lange houdbaarheid hebben) en hoe stabiel ze in het lichaam zijn. (zodat ze langdurige medicijnactiviteit kunnen veroorzaken).
Al deze eigenschappen worden bepaald door het mengsel van moleculen dat wordt gebruikt om de LNP te creëren, en de resulterende 3D-structuur van het deeltje. Het team onder leiding van Yen en collega-co-leiders Greg Hura en Michal Hammel, beiden biofysici van Berkeley Lab, onderzoekt al enkele jaren hoe de structuur van LNP's kan worden afgestemd op de gewenste eigenschappen.
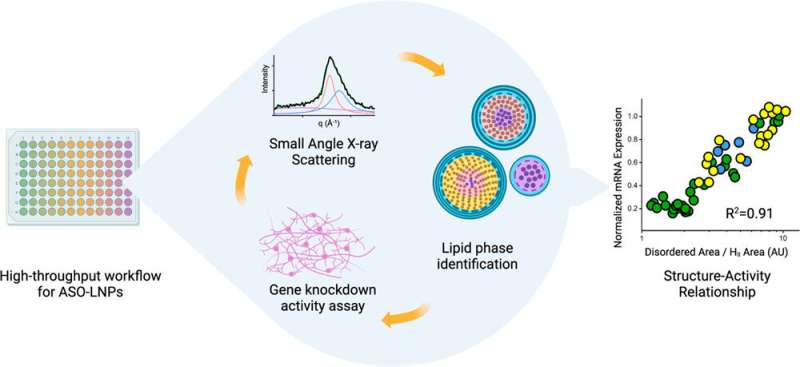
Hun nieuwste artikel, onlangs gepubliceerd in ACS Nano , documenteert hoe een workflow met hoge doorvoer hen in staat stelt LNP's met recordsnelheid te produceren en te karakteriseren. De studie omvat ook de allereerste demonstratie van hoe de LNP-structuur correleert met de activiteit van de inhoud ervan, die voor dit onderzoek een anti-sense oligonucleotide (ASO) was. ASO's zijn kleine stukjes RNA- of DNA-basenparen die genexpressie blokkeren door zich te binden aan mRNA-strengen en te voorkomen dat ze in eiwitten worden vertaald. ASO's zijn een geweldige manier om ziekten te behandelen die worden veroorzaakt door defecte eiwitten of de overvloed aan eiwitten. Maar net als mRNA zijn ze gevoelig voor rondzwervende nucleasen – enzymen die RNA en DNA afbreken – en cellen nemen ze niet gemakkelijk op.
De wetenschappers ontdekten dat ASO-dragende LNP's met netjes geordende, dicht opeengepakte interne structuren leidden tot een betere uitschakeling van een defect gen in menselijke neuronen dat geassocieerd is met een degeneratieve ziekte, vergeleken met LNP's die een meer ongeordende structuur hadden. De bevindingen waren afkomstig van cellulaire activiteiten, niet van dierstudies, dus er is nog meer werk te doen, maar het team is enthousiast om op deze inzichten voort te bouwen met behulp van de complementaire tools van elke instelling.

"Wij genereren de LNP's met een hoge doorvoer en het team van Greg en Michal kan de analyse met hoge doorvoer aanbieden", aldus Yen. "Als je tegenwoordig naar de publicatie kijkt, gebruiken ze meestal slechts een of twee formuleringen, maar voor ons is het anders. We kunnen grote datasets genereren, en ik denk dat dat de reden is waarom we deze zeer unieke en coole vondst kunnen doen."
P>"Dit artikel beschrijft echt de methode die we gaan toepassen op de duizenden andere formuleringen die we willen karakteriseren", voegde Hura toe, die deel uitmaakt van de Biosciences Area van Berkeley Lab. "We hopen dat dit een algemene methode zal zijn voor mensen om hun lipidenanodeeltjes te optimaliseren. Of het nu om vaccins gaat, en nogmaals, de vaccins hebben tot nu toe of daarna de grootste aandacht gekregen. Dit type therapie heeft daarnaast een zeer brede toepassing. ."
Hoe je een lipide-nanodeeltje bouwt
De structuren van LNP's worden beïnvloed door hoe je ze mengt, wat je met elkaar mengt en in welke volgorde. LNP's hebben vier ingrediënten:ioniseerbare lipiden, helperfosfolipiden, cholesterol en polyethyleenglycollipiden (PEG-lipiden) en elk ingrediënt heeft verschillende vormen. Bovendien kunnen ze in verschillende verhoudingen worden gecombineerd, wat leidt tot een exponentieel aantal mogelijke formules. Wat de zaken nog ingewikkelder maakt, is dat de LNP's met de tijd veranderen. Een formulering die begint als een nette, dicht opeengepakte bol zal uiteindelijk veranderen in een meer ongeordende structuur.
Wetenschappers van Genentech hebben een robotgestuurde workflow ontwikkeld die in slechts een paar uur honderden LNP-formuleringen kan genereren. Monsters van elke formulering worden vervolgens naar het Berkeley Lab gebracht om röntgenverstrooiing onder kleine hoeken (SAXS) uit te voeren bij de Advanced Light Source, een cirkelvormige deeltjesversneller die röntgenstralen met verschillende energieën creëert.
De biologische SAXS-bundellijn kan snel veel monsters verwerken, en in tegenstelling tot andere vormen van röntgendiffractie op biologische materialen hoeven de monsters niet te worden ingevroren of gekristalliseerd – wat de structuur van de LNP’s zou kunnen veranderen en de wetenschappers ervan zou kunnen weerhouden te ontdekken wat de LNP's zouden er uitzien bij fysiologische temperaturen in het menselijk lichaam. Met SAXS kunnen ze ook momentopnamen maken van LNP's op specifieke tijdstippen om hun structurele levensduur te bepalen.
Bovendien gebruikt het Genentech-team een versneld proces om te bestuderen hoe LNP's de genexpressie in hun doelcellen beïnvloeden. Door al deze versnelde technieken te combineren, kan de hele samenwerking potentiële LNP's in een ongekend tempo screenen.
Yen is van plan de SAXS-bundellijn te blijven gebruiken om kleine details te bestuderen, zoals hoe een verandering van 1% in de ingrediëntenconcentratie of het gebruik van een nieuwe machine tijdens de productie de cellulaire activiteit van LNP kan beïnvloeden, evenals grote vragen, zoals of LNP's zich anders gedragen als ze andere soorten vracht vervoeren en hoe deze interageren met verschillende doelcellen.
"We weten dat mRNA-LNP's werken, maar er is nog steeds een enorme kenniskloof", zei Yen. "Daarom heb ik het gevoel dat ons artikel een pionier is op dit gebied en hopelijk kunnen we ook meer gegevens en begrip genereren voor toekomstige toepassingen."
Meer informatie: Michal Hammel et al., Correlatie van de structuur en genuitschakelingsactiviteit van met oligonucleotiden geladen lipidenanodeeltjes met behulp van röntgenverstrooiing onder kleine hoeken, ACS Nano (2023). DOI:10.1021/acsnano.3c01186
Journaalinformatie: ACS Nano
Geleverd door Lawrence Berkeley National Laboratory
 Soja-microbeads zijn een milieuvriendelijk alternatief voor plastic microbeads die worden gebruikt in cosmetica, zeep producten
Soja-microbeads zijn een milieuvriendelijk alternatief voor plastic microbeads die worden gebruikt in cosmetica, zeep producten Grote vooruitgang in detectie van nanoporiën van peptiden en eiwitten
Grote vooruitgang in detectie van nanoporiën van peptiden en eiwitten Hoe te meten voor zuurheid of alkaliteit
Hoe te meten voor zuurheid of alkaliteit  Vochtvanger op zonne-energie verzamelt en reinigt water uit de lucht
Vochtvanger op zonne-energie verzamelt en reinigt water uit de lucht Nieuwe methode voor het identificeren van koolstofverbindingen afkomstig van fossiele brandstoffen
Nieuwe methode voor het identificeren van koolstofverbindingen afkomstig van fossiele brandstoffen
 Oost-Antarctische zomerkoelingstrends veroorzaakt door clusters van tropische regenval
Oost-Antarctische zomerkoelingstrends veroorzaakt door clusters van tropische regenval Hoe een toendra-project te maken
Hoe een toendra-project te maken  Zijn dinosaurussen echt? Wat we weten over de uitgestorven wezens
Zijn dinosaurussen echt? Wat we weten over de uitgestorven wezens  In het Braziliaanse Amazonegebied, savannisering en klimaatverandering zullen 12 miljoen mensen blootstellen aan dodelijke hittestress
In het Braziliaanse Amazonegebied, savannisering en klimaatverandering zullen 12 miljoen mensen blootstellen aan dodelijke hittestress Milieuwetenschappers:tot 20% van de wereldwijde grondwaterbronnen dreigt op te drogen
Milieuwetenschappers:tot 20% van de wereldwijde grondwaterbronnen dreigt op te drogen
Hoofdlijnen
- Oud skelet onthult amputatie-operatie 31.000 jaar geleden
- Onderzoek suggereert vrouwelijk voordeel in levensverwachting gerelateerd aan fundamentele biologische wortels
- Herstel van veengebieden:overstromingen zijn niet de ideale oplossing
- De gevoeligheid van microben voor veranderingen in de omgeving hangt af van de bodemdiepte
- Hoe beïnvloedt de structuur van DNA zijn functie?
- Wandelstranden, vrijwilligers verzamelen gegevens over dode zeevogels
- Snel leven, jong sterven:studie onthult de impact van habitatverstoring op de sociale organisatie van Arabische babbelaars
- Een omkeerbare hoofdschakelaar ontdekken voor ontwikkeling
- IJsberen verdringen op Russisch eiland in teken van Arctische verandering
- Tweedimensionale materialen zien groeien

- Hefboom-geïnspireerde tribo-elektrische nanogenerator met ultrahoge output voor pulsbewaking
- Gebruikmaken van onvolkomenheden om beter gedragende kwantumstippen te creëren

- Onderzoekers koken nieuwe batterijanodes met wilde paddenstoelen

- Onderzoekers zetten een stap in de richting van het creëren van een asrotor-nanomachine

 Onderzoekers creëren aerogels met vormgeheugen met rubberachtige elasticiteit
Onderzoekers creëren aerogels met vormgeheugen met rubberachtige elasticiteit Typen lichtsensoren
Typen lichtsensoren  Het semester cijfer
Het semester cijfer  Afbeelding:Ries-krater, Duitsland
Afbeelding:Ries-krater, Duitsland Nucleair moet klimaatcrisis gebruiken om hoge kosten te rechtvaardigen, MIT zegt:
Nucleair moet klimaatcrisis gebruiken om hoge kosten te rechtvaardigen, MIT zegt: Waarom wordt magnesiumchloride gebruikt in PCR?
Waarom wordt magnesiumchloride gebruikt in PCR?  Alles wat u moet weten over DNA-tests
Alles wat u moet weten over DNA-tests In het laboratorium gekweekte zuivel:de volgende voedselgrens
In het laboratorium gekweekte zuivel:de volgende voedselgrens
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

