Wetenschap
Verbetering van kankertherapie met behulp van gefunctionaliseerde fotosynthetische bacteriën
Het met hoge precisie richten op kwaadaardige tumoren is een uitdaging voor biomedische onderzoekers. Dit scenario zal in de nabije toekomst waarschijnlijk getuige zijn van een paradigmaverschuiving door het gebruik van speciaal ontworpen bacteriën die kwaadaardige cellen efficiënt kunnen elimineren.
Het gebruik van bacteriën om zich op kankercellen te richten, of bacteriële therapie, kan verder worden verbeterd door middel van genetische manipulatie en nanotechnologie. De werkzaamheid ervan kan echter worden belemmerd vanwege technische beperkingen en de mogelijke ontwikkeling van antibioticaresistentie. Daarom is het van cruciaal belang om de gematigde maar effectieve chemische modificatie van bacteriën te bereiken voor verbeterde biocompatibiliteit en functionaliteit, zodat hun medische capaciteiten niet in gevaar komen.
Onlangs zijn bepaalde soorten paarse fotosynthetische bacteriën (PPSB) in de schijnwerpers gekomen vanwege hun potentieel om de uitdagingen van bacteriële therapie aan te pakken. Om dit verder te onderzoeken, publiceerden onderzoekers een onderzoek in Nano Today waarin melding wordt gemaakt van het gebruik van chemisch gemodificeerde PPSB voor het detecteren en elimineren van moeilijk uit te roeien kankercellen in een muismodel.
De studie, geleid door universitair hoofddocent Eijiro Miyako van het Japan Advanced Institute of Science and Technology (JAIST), selecteerde Rhodopseudomonas palustris (RP) als de optimale bacterie voor het uitvoeren van de onderzoeken. "RP vertoonde uitstekende eigenschappen, zoals nabij-infrarood (NIR) fluorescentie, fotothermische conversie en lage cytotoxiciteit. Het absorbeert NIR-licht en produceert vrije radicalen - een eigenschap die kan worden gebruikt om kankercellen te doden", legt prof. Miyako uit. /P>
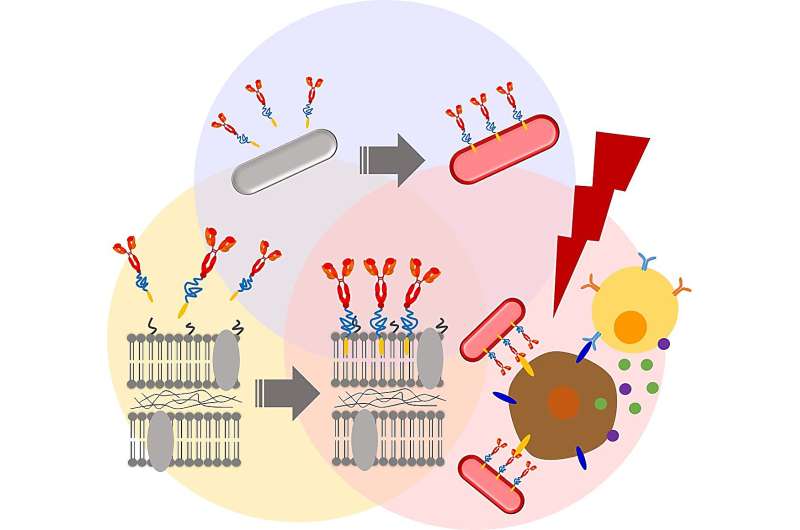
In een poging de therapeutische werkzaamheid van de geïsoleerde stam te verbeteren, zocht het team naar chemische modificaties om de bacteriële membranen te veranderen. Eerst voerden ze membraan-PEGylatie uit, of de hechting van polyethyleenglycolderivaten aan de bacteriële celwanden. Uit eerder onderzoek blijkt dat bacteriële PEGylatie helpt bij het omzeilen van de immuunrespons van de gastheer en lichtenergie omzet in warmte, die vervolgens kan worden gebruikt om kankercellen selectief te elimineren.
De eerste resultaten waren bemoedigend. Het coaten van het RP-membraanoppervlak met een biocompatibel anker voor membraan (BAM) had bijvoorbeeld gedurende minstens een week geen nadelige invloed op de levensvatbaarheid van de RP-cellen. Bovendien werden de BAM-gefunctionaliseerde RP's niet geëlimineerd via fagocytose door macrofagen – cellen die een sleutelrol spelen in de verdedigingsacties van het immuunsysteem tegen bacteriële invasies.
Vervolgens bevestigden de onderzoekers een fluorescerend Alexa488-BSA-conjugaat aan de BAM-gefunctionaliseerde RP's, waardoor een bacterieel complex ontstond met een traceerbare fluorescerende marker. Dit conjugaat werd vervolgens vervangen door een PD-L1-antilichaam. Eerdere studies hebben aangetoond dat kankercellen op hun oppervlak een eiwit tot expressie brengen dat Programmed Cell Death Ligand 1 (PD-L1) wordt genoemd. PD-L1 kan het afweersysteem van de gastheer soepel uitschakelen door zich te binden aan PD-1-receptoren. Hierdoor kunnen de kankercellen de immuundetectie en eliminatie omzeilen. Anti-PD-L1-antilichamen blokkeren deze interactie en voorkomen zo dat kankercellen de door het immuunsysteem gemedieerde vernietiging kunnen omzeilen.
Zoals verwacht remden zowel anti-PD-L1-BAM-RP als RP de tumorgroei in een muizenmodel van darmkanker. Anti-PD-L1–BAM–RP, BAM–RP en RP vertoonden echter, wanneer ze werden geëxciteerd met een laser, een bijzonder dramatisch antikankereffect. In feite verdwenen solide tumoren volledig na de laserbestraling van anti-PD-L1 – BAM – RP, BAM – RP of RP die in tumordragende muizen werden geïnjecteerd. Verder vertoonden bij het beoordelen van de fotothermische conversie-eigenschappen zowel anti-PD-L1–BAM–RP als natuurlijk RP een sterke fotothermische conversie als gevolg van de aanwezigheid van door licht aangedreven bacteriochlorofyl (BChl) moleculen.
Van de verschillende bioconjugaten vertoonde anti-PD-L1-BAM-RP de hoogste werkzaamheid in de beginfase van de behandeling. Bovendien was het niet giftig voor omringende gezonde cellen of voor de muizengastheer. Daaropvolgende experimenten onthulden het onderliggende mechanisme van de vernietiging van colontumoren in het muismodel.
"Onze bevindingen onthulden dat door licht aangedreven functionele bacteriën effectieve optische en immunologische functies vertoonden in het muizenmodel van darmkanker. Bovendien werd de NIR-fluorescentie van de gemanipuleerde bacteriële complexen gebruikt om tumoren te lokaliseren, wat effectief de weg vrijmaakte voor toekomstige klinische vertalingen." zegt prof. Miyako.
Hij voegt er verder aan toe:"Wij geloven dat deze bacteriële technologie over tien jaar beschikbaar zou kunnen zijn voor klinische proeven en positieve implicaties zou kunnen hebben voor de diagnose en therapie van kanker."
Meer informatie: Sheethal Reghu et al, Immunotheranostiek bij kanker met behulp van bioactieve fotosynthetische bacteriële complexen met nanocoating, Nano Today (2023). DOI:10.1016/j.nantod.2023.101966
Journaalinformatie: Nano vandaag
Aangeboden door het Japan Advanced Institute of Science and Technology
 Micropijlercompressie voor het vinden van hittebestendige legeringen
Micropijlercompressie voor het vinden van hittebestendige legeringen Chemicus stelt nieuwe manier voor om de brandstofkwaliteit te verbeteren met behulp van microgolfstraling
Chemicus stelt nieuwe manier voor om de brandstofkwaliteit te verbeteren met behulp van microgolfstraling Microscopische strijdwagens leveren moleculen in onze cellen
Microscopische strijdwagens leveren moleculen in onze cellen Onderzoekers rapporteren nieuwe oxyfluorideverbinding voor fotokatalyse
Onderzoekers rapporteren nieuwe oxyfluorideverbinding voor fotokatalyse Chemische makers verzetten zich tegen nieuwe tarieven
Chemische makers verzetten zich tegen nieuwe tarieven
 Geheimen van verborgen ijscanyons onthuld
Geheimen van verborgen ijscanyons onthuld Het onderschatte verkoelende effect op de planeet van historische branden
Het onderschatte verkoelende effect op de planeet van historische branden Het verschil tussen smog en mist
Het verschil tussen smog en mist  Veranderingen in de baan van de aarde maakten de opkomst van complex leven mogelijk
Veranderingen in de baan van de aarde maakten de opkomst van complex leven mogelijk Nederlandse rechter beveelt regering meer te doen aan luchtvervuiling
Nederlandse rechter beveelt regering meer te doen aan luchtvervuiling
Hoofdlijnen
- De mens als model voor het begrijpen van biologische fundamenten
- Indonesische smokkelaars stopten exotische vogels in pijpen:politie
- Mexico vangt zeldzame vaquita-bruinvis om soorten te redden
- Wat zijn de functies van Triglyceride Phospholipid & Sterol?
- Machine learning toont verbanden tussen de groei van de bacteriële populatie en de omgeving
- EU-handelsverbod verlaagt wereldhandel in wilde vogels met 90 procent
- Een 3D-model voor celbiologische projecten bouwen Mitochondria en chloroplast
- Zelfgemaakt skeletmodel
- Waarom wordt magnesiumchloride gebruikt in PCR?
 Een benadering voor bewegingsplanning op asteroïde oppervlakken met onregelmatige zwaartekrachtvelden
Een benadering voor bewegingsplanning op asteroïde oppervlakken met onregelmatige zwaartekrachtvelden Lessen die kunnen worden getrokken uit Ghana's overtollige elektriciteitspuinhoop
Lessen die kunnen worden getrokken uit Ghana's overtollige elektriciteitspuinhoop Australië voert hulp aan boeren op naarmate de droogte toeslaat
Australië voert hulp aan boeren op naarmate de droogte toeslaat Geavanceerde landbouwrobots bieden een goedkope reddingslijn voor Britse boeren
Geavanceerde landbouwrobots bieden een goedkope reddingslijn voor Britse boeren Hoe Montessori-methoden te gebruiken om te leren tellen
Hoe Montessori-methoden te gebruiken om te leren tellen  Google Flights wil luchtreizigers geld besparen met nieuwe waarschuwingen op nabijgelegen luchthavens, reis data
Google Flights wil luchtreizigers geld besparen met nieuwe waarschuwingen op nabijgelegen luchthavens, reis data Microplastics zitten in onze meststoffen en bodems, maar we weten zo goed als niets over hun milieu- en gezondheidseffecten
Microplastics zitten in onze meststoffen en bodems, maar we weten zo goed als niets over hun milieu- en gezondheidseffecten Op zoek naar vingerafdrukken op het snijvlak van weer en klimaat
Op zoek naar vingerafdrukken op het snijvlak van weer en klimaat
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com