
Wetenschap
Een nieuwe techniek voor het isoleren van intacte lysosomen uit celculturen
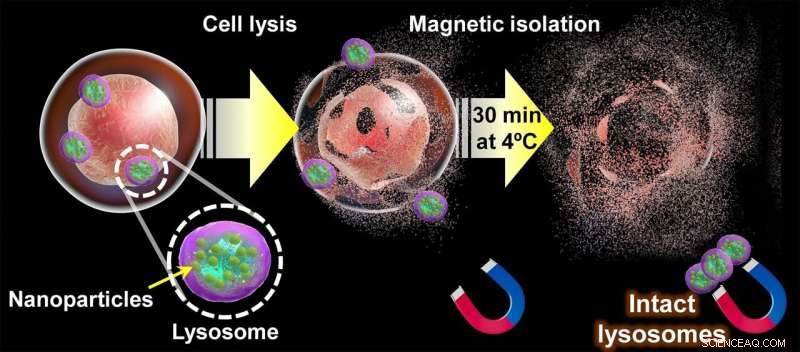
Diagram van de voorgestelde aanpak voor het extraheren van intacte lysosomen. Zodra magnetische nanodeeltjes zich op natuurlijke wijze hebben opgehoopt in de lysosomen van een cel via de endocytische route, wordt het celmembraan gescheurd. en de inhoud ervan wordt gedurende 30 minuten "gezeefd" met behulp van magneten. Aan het einde van dit proces kunnen intacte lysosomen uit de magneten worden gehaald en worden gebruikt om hun structuur, metabolieten en eiwitsamenstelling te bestuderen. Krediet:Shinya Maenosono
Het correct functioneren van cellen berust op de nauwkeurige orkestratie van vele complexe processen en organellen. Lysosomen - vitale celorganellen - zijn met enzymen gevulde subeenheden die in veel dierlijke cellen worden aangetroffen en die helpen bij het afbreken en hergebruiken van macromoleculen, zoals eiwitten, lipiden en nucleotiden. Naast hun functie bij cellulaire vertering en afvalbeheer, nemen lysosomen ook deel aan aminozuursignalering, wat naast andere effecten de eiwitsynthese stimuleert.
Aangezien veel ziekten worden veroorzaakt door defecten in de lysosoomfunctie, is het geen verrassing dat onderzoekers al tientallen jaren actief proberen deze organellen te begrijpen. Maar er zijn maar een paar technieken die de extractie van lysosomen vanuit een cel mogelijk maken. De meest gebruikelijke methode wordt "density gradient ultracentrifugation" genoemd. Het omvat het voorzichtig breken van het celmembraan en het uitoefenen van een centrifugale kracht op de inhoud van de cel. Dit scheidt de celcomponenten op dichtheid. Helaas hebben sommige andere organellen dezelfde dichtheid als lysosomen, wat resulteert in monsters met onzuiverheden. Bovendien duurt het proces zo lang dat tegen de tijd dat het klaar is, veel lysosomale eiwitten al verloren en/of afgebroken zijn.
Een meer geavanceerde techniek, 'immunoprecipitatie' genaamd, is gebaseerd op het modificeren van de oppervlakte-eiwitten van lysosomen, zodat ze kunnen worden opgevangen door magnetische kralen bedekt met speciaal op maat gemaakte antilichamen. Hoewel deze benadering zuiverdere resultaten oplevert, wordt de eiwitsamenstelling van de geëxtraheerde lysosomen door de procedure gewijzigd en kunnen daaropvolgende eiwitanalyses worden aangetast. Het is dus duidelijk dat we een betere manier moeten vinden om lysosomen uit cellen te extraheren.
Gelukkig is een team van wetenschappers onder leiding van prof. Shinya Maenosono van het Japan Advanced Institute of Science and Technology (JAIST) op de voorgrond getreden en heeft een nieuwe strategie ontwikkeld om intacte lysosomen snel met hoge zuiverheid te scheiden. Deze studie is gepubliceerd in ACS Nano en ook Prof. Kazuaki Matsumura en Associate Prof. Yuichi Hiratsuka van JAIST, en Prof. Tomohiko Taguchi van Tohoku University, Japan.
Hun strategie is gecentreerd rond het gebruik van magnetische-plasmonische hybride nanodeeltjes (MPNP's) gemaakt van zilver en een ijzer-kobaltlegering en bedekt met een verbinding genaamd aminodextraan (aDxt). De basis voor deze benadering is dat de met aDxt bedekte MPNP's van nature door de cellen worden opgenomen via "endocytose", die culmineert in lysosomen. Zodra er voldoende MPNP's zijn verzameld in de lysosomen, kunnen de cellen voorzichtig worden "geplet" en kunnen de lysosomen worden teruggewonnen met behulp van magneten.
Om deze methode te laten werken, is het essentieel dat MPNP's zich alleen in lysosomen bevinden en niet in andere organellen. Dit is waar plasmonbeeldvorming van pas komt, omdat de duidelijke manier waarop plasmonische nanodeeltjes interageren met licht, ze gemakkelijk te visualiseren maakt met een optische microscoop. Door elk type organel in de endocytische route anders te kleuren met behulp van immunokleuring en te controleren hoe de locatie van MPNP's ermee overlapt, bepaalden de onderzoekers de precieze tijd die de meeste MPNP's nodig hebben om de lysosomen te bereiken. Dit zorgt er op zijn beurt voor dat het scheidingsproces lysosoommonsters met een hoge zuiverheid oplevert.
Daarna analyseerde het team de effecten van temperatuur en magnetische scheidingstijd op de eiwitsamenstelling van de geëxtraheerde lysosomen. Hun resultaten toonden aan dat het eiwitverlies opmerkelijk snel was, zelfs bij temperaturen zo laag als 4°C. Gelukkig was hun aanpak snel genoeg om intacte lysosomen te extraheren, zoals prof. Maenosono benadrukt:"We ontdekten dat de maximale tijd die nodig was om lysosomen te isoleren na celbreuk 30 minuten was, wat aanzienlijk korter is dan de tijd die nodig is met behulp van op centrifugatie gebaseerde technieken, die typisch een minimale scheidingstijd van enkele uren vereisen."
Over het algemeen zal deze nieuwe techniek onderzoekers helpen de fragiele metabolieten van lysosomen te onderzoeken en hoe ze veranderen als reactie op stimuli. Dit zal op zijn beurt de weg vrijmaken voor nieuwe inzichten in aandoeningen gerelateerd aan lysosomale disfunctie. In dit verband merkt prof. Maenosono op:"Gezien de diepgaande relatie van lysosomen met veel cellulaire metabolieten, is een dieper begrip van de lysosomale functie nodig om de regulatie ervan in verschillende celtoestanden te bepalen. Daarom kan onze techniek bijdragen aan een beter begrip en behandeling van lysosomale ziekten in de toekomst." Bovendien zou deze nieuwe benadering kunnen worden aangepast om naast lysosomen ook andere organellen te extraheren. Hopelijk brengt deze studie ons dichter bij het begrijpen van de inhoud van cellen in een veel hogere mate. + Verder verkennen
Onderzoekers voeren metabolomische profilering uit van individuele vergrote lysosomen
 Plastic afbreken in zijn samenstellende delen
Plastic afbreken in zijn samenstellende delen  Wetenschappers onthullen structurele geheimen van baleinwalvissen
Wetenschappers onthullen structurele geheimen van baleinwalvissen Theoretici bewijzen eindelijk dat gekrulde pijlen de waarheid vertellen over chemische reacties
Theoretici bewijzen eindelijk dat gekrulde pijlen de waarheid vertellen over chemische reacties Rise of the mutants:nieuw onderzoek om enzymontwerpmethodologieën te verbeteren
Rise of the mutants:nieuw onderzoek om enzymontwerpmethodologieën te verbeteren Loodhalogenide perovskieten met verbeterde luminescentie en stabiliteit
Loodhalogenide perovskieten met verbeterde luminescentie en stabiliteit
 Arctic was ooit weelderig en groen, en zou weer kunnen zijn, nieuw onderzoek toont aan
Arctic was ooit weelderig en groen, en zou weer kunnen zijn, nieuw onderzoek toont aan Stormslagers Bermuda, dwingt annulering van vluchten af
Stormslagers Bermuda, dwingt annulering van vluchten af Meer overstromingen en waterschaarste in het verschiet, maar er is nog tijd om de ernst ervan te verminderen
Meer overstromingen en waterschaarste in het verschiet, maar er is nog tijd om de ernst ervan te verminderen Fracking gekoppeld aan verminderd succes bij het nestelen van zangvogels
Fracking gekoppeld aan verminderd succes bij het nestelen van zangvogels Kaspische Zee-landen ondertekenen mijlpaalovereenkomst
Kaspische Zee-landen ondertekenen mijlpaalovereenkomst
Hoofdlijnen
- Flavonoïden van sorghumplanten doden vallegerwormplaag op maïs, kunnen gewas beschermen
- Ideeën voor de dingen Kinderen kunnen met een microscoop bekijken
Kinderen zijn vaak nieuwsgierig naar de wereld om hen heen. Een manier om deze nieuwsgierigheid aan te moedigen, is om ze een manier te bieden om de natuur op een nieuwe en intensiev
- Ribosomen: definitie, functie en structuur (eukaryoten en prokaryoten)
- Vrouwelijke wetenschappers die de wereld veranderden
- Een nieuwe genetische bemonsteringstechniek voor kwelderoogstmuizen en andere kleine zoogdieren
- Onderzoek hoe neuronen in de menselijke huid pigmentatie beïnvloeden
- Blikseminslag vormt tropische wouden
- Kunnen schimmels de grassen van Texas helpen de klimaatverandering het hoofd te bieden?
- Heb jij een dubbelganger? Er is een kans van 1 op een biljoen
- De perfecte diamant laten groeien:simulaties onthullen interessante geometrische patronen
- Driedimensionale zelfassemblage met behulp van dipolaire interactie
- Geavanceerd materiaal voor energieopslag krijgt ongekende analyse op nanoschaal

- Onderzoekers naderen nieuw niet-vluchtig geheugen

- Geleidende nanovezelnetwerken voor flexibele, onbreekbaar, en transparante elektroden

 Hoe werkt een magnetometer?
Hoe werkt een magnetometer?  Hoe de grootte van een aardgeleider
Hoe de grootte van een aardgeleider Wetten bieden beperkte bescherming tegen prijsdifferentiatie door algoritmen
Wetten bieden beperkte bescherming tegen prijsdifferentiatie door algoritmen Grafeen-partnerschap kan lichtere vliegtuigen opleveren
Grafeen-partnerschap kan lichtere vliegtuigen opleveren Explosies van universums eerste sterren spuwden krachtige jets
Explosies van universums eerste sterren spuwden krachtige jets Video:De chemie van het koken van voedsel
Video:De chemie van het koken van voedsel Zonnecellen die bijna alle kanten op kunnen en zichzelf schoon houden
Zonnecellen die bijna alle kanten op kunnen en zichzelf schoon houden Wasbloemen en hun complexe relatie
Wasbloemen en hun complexe relatie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

