
Wetenschap
Diverse amyloïde structuren en dynamiek onthuld door snelle atoomkrachtmicroscopie
Tegoed:Unsplash/CC0 Publiek domein
In het menselijk lichaam, eiwitten komen soms voor in fibrillaire aggregaten die amyloïden worden genoemd. Hoewel bekend is dat bepaalde amyloïden een biologische functie hebben, amyloïde vorming wordt vaak geassocieerd met pathologieën, waaronder de ziekte van Alzheimer en Parkinson. Begrijpen hoe amyloïde fibrillen precies worden gevormd, is cruciaal om inzicht te krijgen in de ontwikkeling van dergelijke ziekten en om vooruitgang te boeken met behandelingsbenaderingen.
Nutsvoorzieningen, Takahiro Watanabe-Nakayama van de Universiteit van Kanazawa, Kenjiro Ono van de Showa Universiteit, en collega's hebben het vormingsproces van bepaalde amyloïde fibrillen onderzocht met behulp van een techniek die visualisatie van groei in de loop van de tijd mogelijk maakt. De wetenschappers keken specifiek naar het effect van het kruisen ('mengen') van verschillende eiwitten die aggregaten vormen, en vond variaties in reksnelheden en de structuren van de fibrillen.
De onderzoekers bestudeerden alfa-synucleïne, een eiwit dat overvloedig aanwezig is in het menselijk brein. Ze keken naar wat er gebeurde als we wildtype alfa-synucleïne-moleculen - de natuurlijke, meest voorkomende variant-vorm aggregaten, en ook hoe aggregatie anders is bij het introduceren van (cross-seeding) mutante varianten geassocieerd met de ziekte van Parkinson. In aanvulling, de wetenschappers onderzochten de invloed van de pH-waarde van de micro-omgeving waarin fibrilgroei plaatsvindt.
Door middel van snelle atoomkrachtmicroscopie (HS-AFM), Watanabe-Nakayama, Ono en collega's konden voor verschillende gevallen fibrilaggregatie opnemen met een resolutie van nanometer en een hoge videosnelheid. Eerst, de wetenschappers keken naar de groei van enkelvoudige varianten (self-seeding). Ze ontdekten dat mutanten meer aggregaten produceerden, of dat ze sneller aggregeerden bij neutrale pH dan de wildtype varianten. Een andere observatie was dat de rek sneller was bij een lagere pH (5,8, d.w.z. zuur) dan bij hogere pH (7,4, d.w.z. basis).
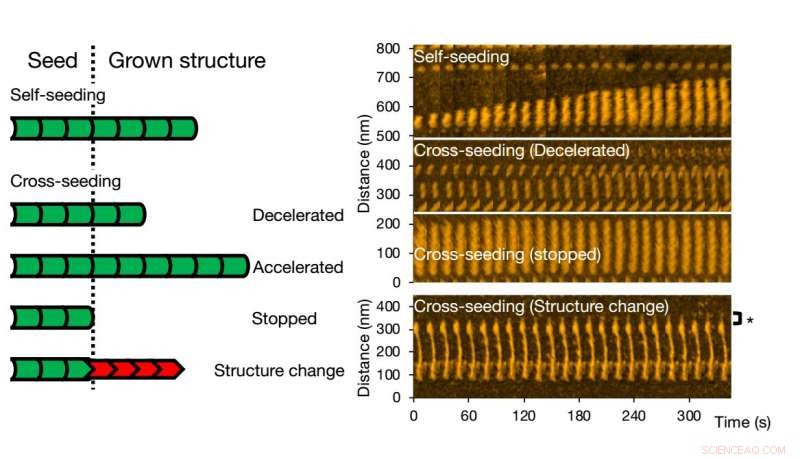
High-speed atomic force microscopie maakt het mogelijk om fibrilvorming van varianten van een enkel eiwit te visualiseren en analyseren. Krediet:Kanazawa University
Voor kruiszaaien, verschillende scenario's kunnen voorkomen. Fibrilgroei kan worden versneld of vertraagd, of zelfs gestopt. De morfologie van het oorspronkelijke zaad kan worden bewaard, maar het komt ook voor dat de structuur van de resulterende fibril anders is - typische structurele vormen zijn 'recht' of 'spiraal'. De onderzoekers hebben door middel van fluorescentie-experimenten gecontroleerd of de fibrilstructuur en -dynamiek zoals waargenomen met HS-AFM overeenkomen met de processen in oplossing; soortgelijke conclusies werden getrokken.
De bevindingen van Watanabe-Nakayama, Ono en collega's zijn relevant voor een beter begrip van amyloïde-gerelateerde ziekten. De onderzoekers citeren:"Cross-seeding gecombineerd met variaties in reksnelheden heeft het effect van het vergroten van de structurele diversiteit van de resulterende samenstellingen. Deze diversiteit kan worden weerspiegeld in duidelijke neurotoxische effecten voor verschillende [eiwit]samenstellingen."
 Zwarte wateren:olielozingen vervuilen kreken in het noordoosten van Syrië
Zwarte wateren:olielozingen vervuilen kreken in het noordoosten van Syrië Diverse geografie van de 82 grootste eilanden van Groot-Brittannië onthuld
Diverse geografie van de 82 grootste eilanden van Groot-Brittannië onthuld Android-telefoons om aardbevingen te volgen; Californië krijgt waarschuwingssysteem
Android-telefoons om aardbevingen te volgen; Californië krijgt waarschuwingssysteem Schone energienetwerken en elektrische voertuigen essentieel om klimaatverandering en luchtvervuiling te verslaan
Schone energienetwerken en elektrische voertuigen essentieel om klimaatverandering en luchtvervuiling te verslaan Planten en dieren in loofbossen
Planten en dieren in loofbossen
Hoofdlijnen
- Hoe is de katoenplant aangepast om te overleven?
- Poema's zijn socialer dan eerder werd gedacht
- Hoe biomimicry werkt
- Onderzoek toont aan dat commerciële oogst van brekende schildpadden leidt tot bevolkingsafname
- Invasieve superschurkenkrab kan door zijn kieuwen heen eten
- Wat gebeurt er met een diercel wanneer deze zich in een hypotone oplossing bevindt?
- Van stroper tot boswachter:de Siberische tijgers van China redden
- Jacht op herten beperkt in westelijke Amerikaanse staten na strenge winter
- Scheepslawaai beïnvloedt het vermogen van mariene soorten om te communiceren
- Kunstmatige intelligentie om de biomoleculaire wereld te verkennen

- Thermische schakelaar ontdekt in op inktvis gebaseerde biomaterialen
- Team gebruikt nanodeeltjes om genen af te leveren in chloroplasten van planten
- Hoe fotonica het spectrum van licht kan veranderen, en herstel Edisons gloeilamp onderweg

- Pool spelen met atomen

 Verzekeringspolis kan de koraalriffen van de aarde redden
Verzekeringspolis kan de koraalriffen van de aarde redden NASA-satelliet vindt een wigvormige tropische storm Paulette
NASA-satelliet vindt een wigvormige tropische storm Paulette Berekening van het dauwpunt, de temperatuur en de relatieve luchtvochtigheid
Berekening van het dauwpunt, de temperatuur en de relatieve luchtvochtigheid Moeten mensen weten dat ze met een algoritme praten? Na een controversieel debuut, Google zegt nu ja
Moeten mensen weten dat ze met een algoritme praten? Na een controversieel debuut, Google zegt nu ja Kleine elektrische spanning verandert de geleidbaarheid in belangrijke materialen
Kleine elektrische spanning verandert de geleidbaarheid in belangrijke materialen Nieuwe 3D-polypyrrool-aerogel-gebaseerde elektromagnetische absorber kan dienen als goedkoop alternatief voor grafeen-aerogels
Nieuwe 3D-polypyrrool-aerogel-gebaseerde elektromagnetische absorber kan dienen als goedkoop alternatief voor grafeen-aerogels COVID-19 verspreidingsmodel laat zien hoe vaccinatie pandemie beïnvloedt
COVID-19 verspreidingsmodel laat zien hoe vaccinatie pandemie beïnvloedt Hoe het gasvolume te meten met behulp van waterverplaatsing
Hoe het gasvolume te meten met behulp van waterverplaatsing
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

