
Wetenschap
IJzeren nanorobots tonen hun ware moed
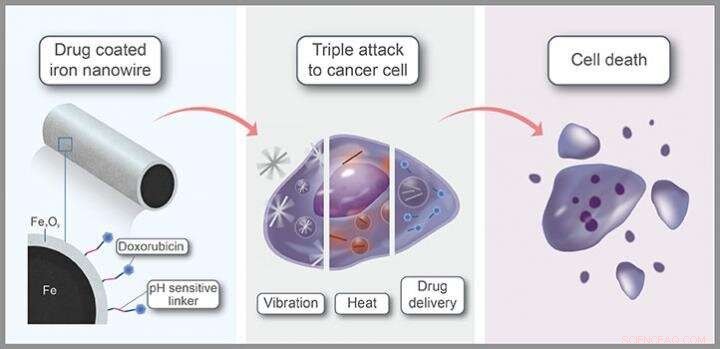
Door magnetische velden met een laag vermogen te combineren, die nanodraden in beweging zet, met laserverwarming en medicijnafgifte, doelcellen kunnen efficiënt worden gedood. Krediet:KAUST
Met medicijnen gecoate ijzeren nanodraden die met behulp van een extern magnetisch veld naar de plaats van een tumor kunnen worden geleid voordat een driestaps kankerdodend mechanisme wordt geactiveerd, kunnen een effectieve optie zijn voor kankertherapie.
Mede ontwikkeld door KAUST-onderzoekers, deze nanodraden geven hun medicijnlading vrij in kankercellen, terwijl ook gaten in het celmembraan worden geponst en een explosie van warmte wordt afgegeven. Terwijl de combinatietherapie de dood van kankercellen maximaliseert, het zeer gerichte karakter ervan zou bijwerkingen moeten minimaliseren.
IJzer was het voor de hand liggende materiaal om de nanodraden te maken, zegt Jurgen Kosel, die de groep leidt bij KAUST, waaronder Jasmeen Merzaban en Boon Ooi, en die samen met onderzoekers van CIC biomaGUNE in San Sebastian het werk leidde, Spanje.
De eerste overweging is veiligheid. "Ijzer, in moleculaire vorm, is een inheems materiaal in ons lichaam, essentieel voor zuurstoftransport, " legt Kosel uit. De nanodraden bestaan uit een ijzeren kern, bedekt met een ijzeroxide schaal. "Op ijzeroxide gebaseerde nanomaterialen zijn goedgekeurd door regelgevende instanties voor gebruik bij magnetische resonantiebeeldvorming en als voedingssupplement in geval van voedingstekorten, " hij zegt.
Naast hun biocompatibiliteit, de magnetische eigenschappen van op ijzer gebaseerde materialen zijn een belangrijk voordeel. "Met behulp van onschadelijke magnetische velden, we kunnen ze vervoeren; concentreer ze in het gewenste gebied; draaien of laten trillen, zoals we deden in deze studie; en zelfs detecteren door middel van magnetische resonantie beeldvorming, " zegt Aldo Martínez-Banderas, een lid van Kosel's team. Het toepassen van magnetische velden met een laag vermogen, het team schudde de nanodraden op een manier die het membraan van doelcellen opende, celdood veroorzaken.
Het extra voordeel is dat kern-schil nanodraden sterk nabij-infrarood licht absorberen, opwarmen terwijl ze dat doen. Omdat licht op deze golflengte tot ver in het lichaam kan doordringen, de nanodraden kunnen worden verwarmd met behulp van lasers die op de tumorplaats zijn gericht. "De core-shell nanodraden vertoonden een extreem hoge fotothermische conversie-efficiëntie van meer dan 80 procent, wat zich vertaalde in een grote intracellulaire warmtedosis, ', zegt Martínez-Banderas.
Eindelijk, het antikankergeneesmiddel doxorubicine werd via pH-gevoelige linkers aan de nanodraden bevestigd. Omdat de tumoromgeving doorgaans zuurder is dan gezond weefsel, de linker wordt selectief afgebroken in of nabij tumorcellen, het medicijn vrijgeven waar het nodig is. "De combinatie van behandeling resulteerde in bijna volledige ablatie van kankercellen en was effectiever dan individuele behandelingen of het middel tegen kanker alleen, ', zegt Martínez-Banderas.
"Bij elkaar genomen, de mogelijkheden van op ijzer gebaseerde nanomaterialen maken ze veelbelovend voor de creatie van biomedische nanorobots, die een revolutie teweeg kunnen brengen in de gezondheidszorg, " voegt Kosel toe. "Hoewel dit misschien futuristisch lijkt, de ontwikkelingen zijn goed op weg."
 Methaan uitgestoten door mensen enorm onderschat, onderzoekers vinden
Methaan uitgestoten door mensen enorm onderschat, onderzoekers vinden Brand sluit snelweg tussen Frankrijk en Spanje af
Brand sluit snelweg tussen Frankrijk en Spanje af Detecteerbare antropogene verschuiving naar zware neerslag boven Oost-China
Detecteerbare antropogene verschuiving naar zware neerslag boven Oost-China Indonesische vrouwen moeten dagelijks zwemmen voor schoon water
Indonesische vrouwen moeten dagelijks zwemmen voor schoon water Orkaan Iota nu een storm van categorie 5 nabij Midden-Amerika
Orkaan Iota nu een storm van categorie 5 nabij Midden-Amerika
Hoofdlijnen
- Verkoudheidsvirussen onthullen een van hun sterke punten
- Cytoskeleton: definitie, structuur en functie (met diagram)
- Fysieke aanpassingen van rondwormen
- Nieuwe bevindingen verduidelijken de rol van de schildklier bij seizoensveranderingen bij zoogdieren
- Biologen ontdekten de paden van groepen van de lophopoor
- DNA-modellen van paperclips maken
- Hoe Punnett Squares
- De delen van een Firefly Bug
- Het verschil tussen histon en nonhiston
- Shigella-bacterie maakt gebruik van een fysieke kracht genaamd endocytose in het celmembraan

- Flat gallium voegt zich bij nieuwe 2D-materialen
- Nanojuice kan de manier waarop artsen de darm onderzoeken verbeteren

- De natuur gebruiken om een revolutionair optisch materiaal te produceren

- Grafeen kan worden versterkt door te vouwen

 Het in beslag nemen van militaire wapens verhoogt de gewelddadige misdaad niet en brengt de veiligheid van de politie niet in gevaar
Het in beslag nemen van militaire wapens verhoogt de gewelddadige misdaad niet en brengt de veiligheid van de politie niet in gevaar Nieuwe ontdekking helpt autoriteiten de herkomst van heroïne te achterhalen
Nieuwe ontdekking helpt autoriteiten de herkomst van heroïne te achterhalen Decimalen leren aan een vierde grader
Decimalen leren aan een vierde grader Gedeeltelijke zonsverduistering raast over noordelijk halfrond
Gedeeltelijke zonsverduistering raast over noordelijk halfrond Opinie:Brazilië moet zijn overgebleven ongecontacteerde inheemse Amazones beschermen
Opinie:Brazilië moet zijn overgebleven ongecontacteerde inheemse Amazones beschermen Warmte kan onzichtbare schade detecteren in betonnen steunen
Warmte kan onzichtbare schade detecteren in betonnen steunen SpaceX opent tijdperk van amateurastronauten, kosmische filmsets
SpaceX opent tijdperk van amateurastronauten, kosmische filmsets China lanceert vrachtraket met benodigdheden voor ruimtestation
China lanceert vrachtraket met benodigdheden voor ruimtestation
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

